
前言
肝细胞癌(HCC)是全球癌症相关死亡的主要原因之一,超过半数患者确诊时已处于晚期,失去手术根治的机会1。近年来,以免疫检查点抑制剂(ICI)联合抗血管生成靶向药物为代表的系统治疗方案,在晚期肝癌中取得了较高的客观缓解率(ORR)2,使得部分初始不可切除的肝癌患者通过转化治疗获得手术机会成为可能。然而,既往转化治疗研究多受限于样本量小、随访期短,缺乏长期生存临床数据。近日,解放军总医院第一医学中心卢实春教授团队于《Hepato Biliary Surgery and Nutrition》期刊上发表了一项重要的回顾性研究,首次公布了免疫靶向联合转化(ICI plus= Immunotarget plus)序贯根治性肝切除术的长期生存数据:转化治疗达部分缓解(PR)或完全缓解(CR)的初始不可切除HCC患者,序贯根治性外科切除术后5年总生存率(OS)可达80.9%,与早期可切除HCC患者直接手术的5年OS(78.1%)相当3,证实了患者经转化治疗获得PR或CR后进行肝切除术的长期获益,为不可切除HCC患者的根治性治疗提供了新的模式。
中晚期HCC根治和长期生存仍存在未满足的临床需求
转化治疗指通过全身或局部治疗,为初始不可切除肝癌患者创造手术切除机会,从而提高手术切除率并最终改善患者预后4。其中,局部治疗包括经动脉化疗栓塞(TACE)、肝动脉灌注化疗(HAIC)和放射治疗(SIRT),数项研究报告了不可切除HCC患者转化治疗后手术的可行性和有效性5-7。随着系统治疗的发展进步,抗血管生成药物联合免疫治疗药物已成为不可切除或中晚期肝癌的重要治疗方式,在实现肝癌转化手术的同时帮助患者实现术后无瘤生存。但不容忽视的是,无论是单一的局部治疗或系统治疗,抑或两者的联用,本质上均非根治性治疗手段,中晚期HCC患者的根治和长期生存仍存在未满足的临床需求。伴随综合治疗的进展,晚期HCC在免疫靶向联合转化序贯外科根治模式的加持下一定程度地突破了疗效的瓶颈,长期生存得到提高8。
转化序贯外科手术方案,首次填补晚期HCC长期生存数据空白
本研究为回顾性队列研究,于2018年12月至2023年12月纳入210例患者,74.7%的患者采用信迪利单抗+仑伐替尼联合治疗,其余患者采用PD-(L)1联合其他抗血管生成靶向药物或联合局部治疗(TACE、HAIC等)。中位治疗周期为5个周期,最短3个周期,最长37个周期。每6-8周根据mRECIST标准评估,达到CR或PR且满足手术条件的患者行根治性肝切除术。其中99例初始不可切除HCC患者接受免疫联合靶向转化治疗后序贯根治性肝切除术(初始不可切除组),111例BCLC A期患者直接接受根治性肝切除术(直接手术组)。初始不可切除组患者术后中位随访时间为31个月,直接手术组为29个月,重点探索两组的长期生存差异。
患者基线特征
直接手术组和初始不可切除组患者之间显示出不同的临床特征。患者ECOG-PS评分均为0或1,Child-Pugh分级为A或B,均接受R0根治性切除,基线特征具有可比性(除肿瘤相关指标外)。两组在肿瘤负荷和生物学特征上存在显著差异。初始不可切除组的中位肿瘤直径显著更大,甲胎蛋白>400ng/mL的患者比例更高,大多数患者处于BCLC-C期,仅3例患者为BCLC-A期伴肿瘤破裂。
疗效
初始不可切除组中,根据mRECIST标准,62例(62.6%)患者达到PR,15例(15.2%)达到CR;18例(18.2%)为疾病稳定(SD),4例(4.0%)为疾病进展(PD)。转化治疗后,患者血清AFP、PIVKA-II水平显著下降(P值均<0.001),中位肿瘤直径从89mm缩小至59mm(P<0.001)(图1)。与直接手术组相比,初始不可切除组转化治疗后术前AFP水平已无显著差异(7.46ng/mL vs. 8.03ng/mL,P=0.50),PIVKA-II水平更优(61mAU/mL vs. 204mAU/mL,P=0.02)。
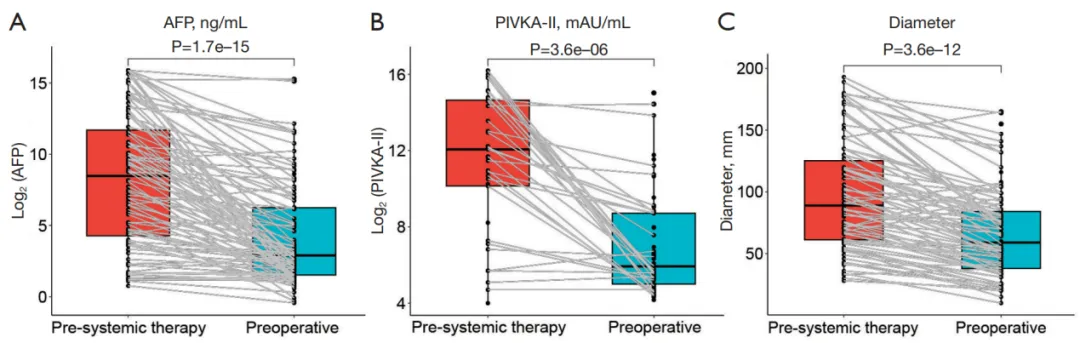
图1 AFP、PIVKA-II水平和中位肿瘤直径比较
(引自《Hepato Biliary Surgery and Nutrition》截图)
初始不可切除组患者的1年、3年、5年OS与直接手术组相比分别为99.0% vs. 97.3%、81.3% vs. 91.2%、73.2% vs. 78.1%,无显著差异(图2)。即使是BCLC C期患者,经免疫联合靶向治疗达CR+PR后,5年OS仍与直接手术组相当(图3)。初始不可切除组中CR+PR患者的1年、3年无复发生存率(RFS)与直接手术组相比分别为75.9% vs. 86.5%、55.9% vs. 63.8%(图4),虽低于直接手术组,但考虑其基线肿瘤负荷更高,仍展现出良好的复发控制效果。
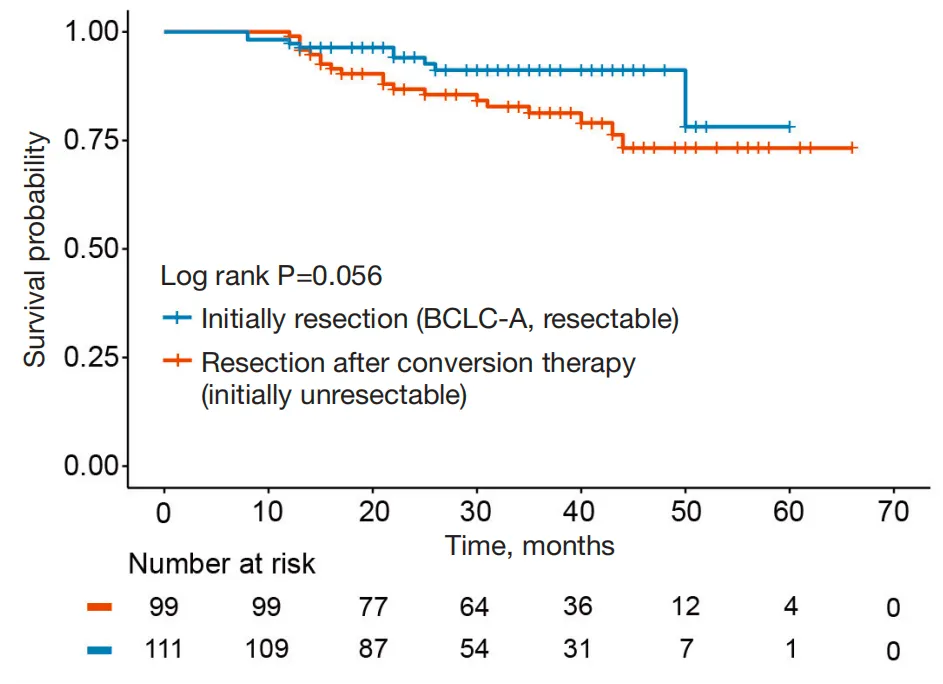
图2 初始不可切除组与直接手术组的OS生存曲线分析
(引自《Hepato Biliary Surgery and Nutrition》截图)
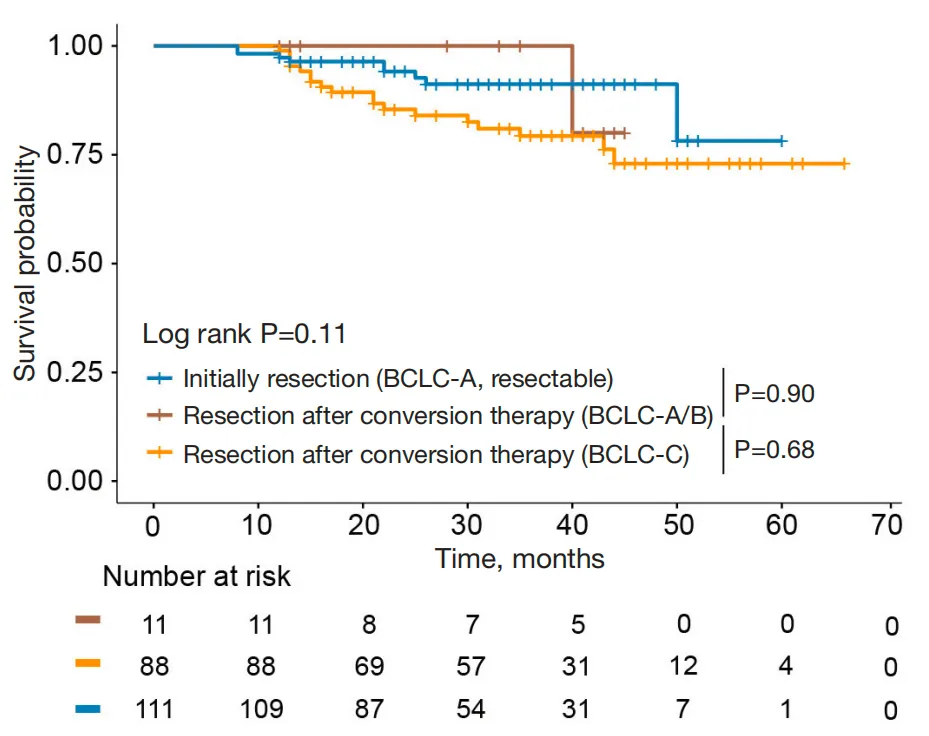
图3 初始不可切除组(BCLC-C)与直接手术组的OS生存曲线分析
(引自《Hepato Biliary Surgery and Nutrition》截图)
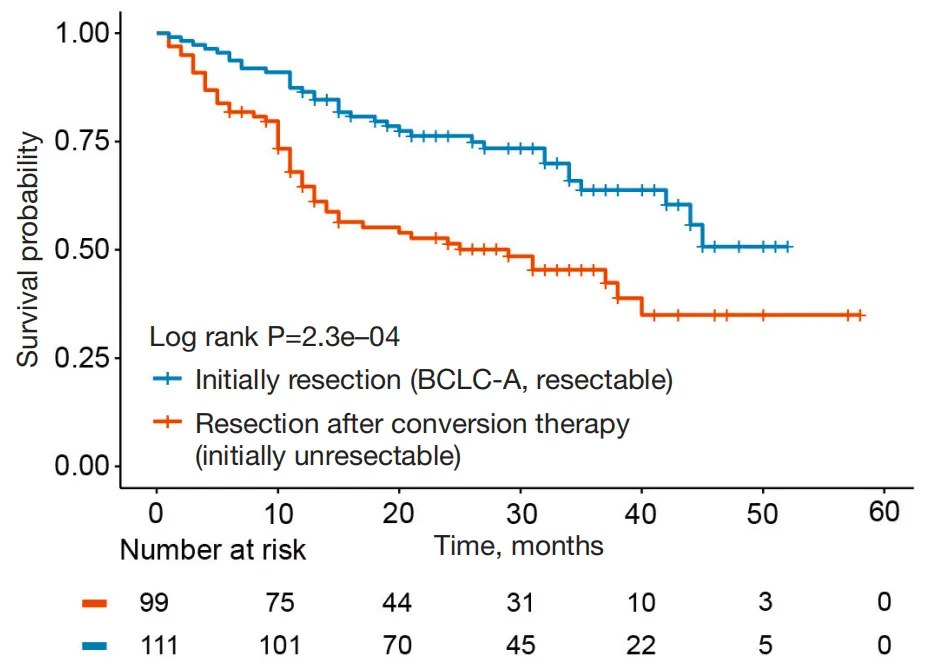
图4 初始不可切除组与直接手术组的RFS生存曲线分析
(引自《Hepato Biliary Surgery and Nutrition》截图)
根据mRECIST标准,进一步将接受转化治疗的患者分为PR+CR组和PD+SD组。分析显示,PR+CR组患者的OS和RFS与接受直接肝切除的BCLC-A期HCC患者相当(图5)。然而,PD+SD组患者的OS和RFS显著短于其他两个亚组。研究进一步针对接受转化治疗的BCLC-C期HCC患者进行分析,PR+CR亚组的OS和RFS与接受直接手术的BCLC-A期患者同样相当,而SD+PD组患者的OS和RFS则更差(图6)。
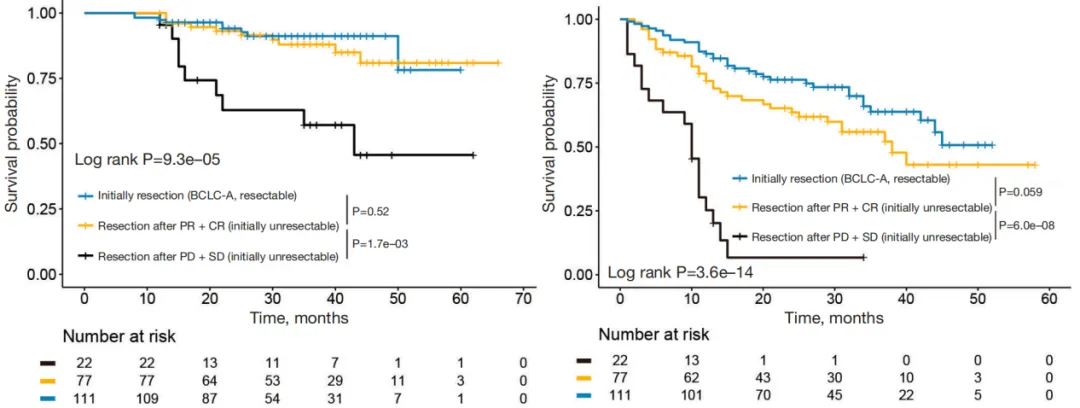
图5 初始不可切除组与直接手术组的OS(左)、RFS(右)分层曲线
(引自《Hepato Biliary Surgery and Nutrition》截图)
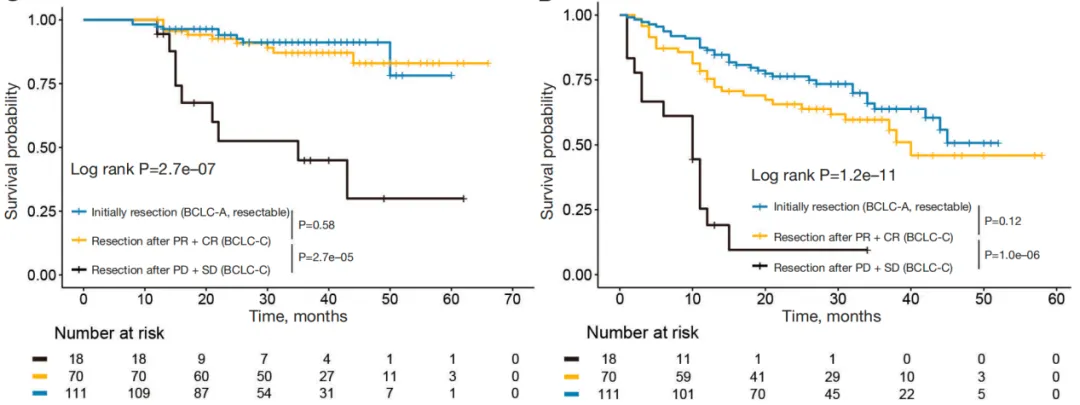
图6 初始不可切除组(BCLC-C)与直接手术组的OS(左)、RFS(右)分层曲线
(引自《Hepato Biliary Surgery and Nutrition》截图)
安全性
68%的患者出现治疗相关不良事件(TRAEs),16%为3-4级TRAEs,无新增非预期毒性;初始不可切除组的术后并发症发生率虽高于直接手术组,但均在可管理范围内。
术后长期生存的多因素分析
对于初始不可切除的HCC患者,经免疫靶向联合转化序贯根治手术,能获得与早期手术患者相当的长期生存结局,其背后蕴含着多个因素。
首先,转化治疗疗效是核心影响因素。转化治疗降低初始不可切除HCC患者的肿瘤负荷,从而可能消除影响预后的微转移,并达到与BCLC-A期患者相似的MVI和卫星结节发生率。研究显示,尽管初始不可切除组患者肿瘤负荷显著更大、恶性程度更高,但在获得PR/CR后,其术后病理中的MVI与卫星结节发生率与直接手术组无显著差异。
其次,初始不可切除组患者基线肿瘤负荷显著更高,存在更高比例的血管侵犯、肝外转移情况,这些均为肝癌预后的不利因素。但经转化治疗后,患者血清肿瘤标志物(AFP、PIVKA-II)水平显著下降,肿瘤直径明显缩小,部分患者的血管侵犯、肝外转移病灶得到控制或消除,为根治性手术创造了条件,同时也改善了肿瘤生物学行为,为术后长期生存奠定基础。
免疫联合靶向治疗可能诱导长期的免疫记忆和监控,产生抗肿瘤效应,有助于减少术后肿瘤复发和转移。PD-1抑制剂与抗血管生成药物形成协同作用,可重塑肿瘤血管微环境,减少免疫抑制性细胞浸润,增强其对CD8⁺T细胞的激活效果。这种联合治疗不仅能直接杀伤肿瘤细胞,更能诱导长期免疫记忆,持续监控并清除潜在的残留肿瘤细胞,从而降低术后复发风险,延长患者生存时间。
再者,根治性手术治疗亦至关重要,在及时清除潜在耐药的异质性病灶的同时,防止持续使用免疫和靶向药物产生不可逆的毒副作用,降低治疗相关不良反应对患者生存质量和生存时间的影响。
总结
本研究报道了对于初始不可切除的HCC患者,在进行免疫靶向联合转化成功治疗后(依据mRECIST标准评估疗效达到PR或CR)实施根治性肝切除术,可获得令人满意的长期生存结局(5年OS率80.9%),其预后与BCLC-A期HCC患者直接接受手术治疗相当,填补了该治疗领域长期生存数据空白。然而本研究作为单中心回顾性设计,存在一定局限性,未来需通过多中心、大样本和前瞻性试验进一步验证,为更多不可切除的HCC患者带来长期生存的希望。
专家简介

卢实春 教授
中国人民解放军总医院
主任医师,教授,博士,博士生导师
现任中国人民解放军总医院肝胆胰外科医学部学术主任
中华预防医学会肝胆胰疾病预防与控制专业委员会主任委员
中华医学会器官移植分会第九届委员
北京医学会器官移植分会第八届副主任委员
中华肝胆外科杂志副总编
中华外科杂志编委
参考文献:
1. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249.
2. Ren Z, Xu J, Bai Y, Xu A, Cang S, Du C, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study. Lancet Oncol. 2021 Jul;22(7):977-990.
3. Li X, Zhang Z, Li J, et al. Long-term outcome of hepatectomy following conversion therapy for initially unresectable hepatocellular carcinoma versus direct hepatectomy for early-stage hepatocellular carcinoma. Hepatobiliary Surgery And Nutrition, 0. doi:10.21037/hbsn-2025-125
4. Song T, Lang M, Ren S, Gan L, Lu W. The past, present and future of conversion therapy for liver cancer. Am J Cancer Res. 2021 Oct 15;11(10):4711-4724. PMID: 34765289; PMCID: PMC8569342.
5. Zhu XD, Huang C, Shen YH, et al. Downstaging and Resection of Initially Unresectable Hepatocellular Carcinoma with Tyrosine Kinase Inhibitor and Anti-PD-1 Antibody Combinations. Liver Cancer 2021;10:320-9.
6. Zhang J, Zhang X, Mu H, et al. Surgical Conversion for Initially Unresectable Locally Advanced Hepatocellular Carcinoma Using a Triple Combination of Angiogenesis Inhibitors, Anti-PD-1 Antibodies, and Hepatic Arterial Infusion Chemotherapy: A Retrospective Study. Front Oncol 2021;11:729764.
7. Ma Z, Xiao Z, Yin P, et al. Comparison of survival benefit and safety between surgery following conversion therapy versus surgery alone in patients with surgically resectable hepatocellular carcinoma at CNLC IIb/IIIa stage: a propensity score matching study. Int J Surg 2024;110:2910-21.
8. 中华预防医学会肝胆胰疾病预防与控制专业委员会,中国抗癌协会肝癌专业委员会,北京医学会外科学分会肝脏学组,等.晚期肝细胞癌免疫靶向联合转化序贯外科治疗专家共识(2024版)[J].临床肝胆病杂志,2025,41(01):30-40.
编辑:Chiu
审校:Arrival
排版:Sylvia
执行:Faline
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。



