摘要
干细胞治疗,作为再生医学的核心,正经历从实验室探索到产业化落点的关键转折。本报告系统梳理了干细胞治疗的科学基础、全球与中国市场的发展历程、政策监管演进、产业链竞争格局,并深入分析了当前面临的技术挑战与未来趋势。
随着“现货型”异体治疗成为主流、iPSC等技术走向成熟、以及全球监管路径的清晰,干细胞治疗已步入黄金发展期,市场规模有望在未来十年迎来爆发式增长,彻底改变诸多难治性疾病的治疗格局。
科学基石——干细胞的核心概念与医疗潜力
干细胞治疗的本质,是调动生命体自身的修复潜能。干细胞是一类具有自我更新能力和多向分化潜能的特殊细胞,堪称人体组织再生的“种子细胞库”。
1.1 干细胞的分类体系
根据分化潜能,干细胞可分为三类:全能干细胞(如受精卵,能发育为完整个体)、多能干细胞(如胚胎干细胞,能分化为三个胚层的所有细胞类型)和单能干细胞(如造血干细胞,通常定向分化为特定谱系)。
在临床转化中,按发育阶段和来源的分类更具现实意义:
胚胎干细胞:源于早期胚胎,分化能力最强,但受限于伦理争议与免疫排斥风险。
成体干细胞:存在于骨髓、脂肪、牙髓等成熟组织中,如间充质干细胞和造血干细胞,是当前临床应用的基石。
诱导多能干细胞:通过基因重编程技术将体细胞“逆转”为类胚胎干细胞状态,兼具强大分化能力与规避伦理问题的潜力,是未来技术竞争的高地。
1.2 干细胞治疗的原理与广阔前景
干细胞治疗通过移植这些“种子细胞”,使其在患者体内归巢、定植、分化为所需的功能细胞,或通过分泌因子调节免疫与微环境,从而实现组织再生与功能修复。其应用场景极为广泛:
组织修复与再生:治疗骨关节炎、软骨损伤、皮肤烧伤、牙周再生等。
神经系统疾病:为帕金森病、阿尔茨海默病、脊髓损伤、脑卒中后遗症等提供细胞替代疗法。
免疫系统疾病:用于调节系统性红斑狼疮、类风湿关节炎、移植物抗宿主病等。
代谢性疾病:旨在通过再生胰岛细胞功能,从根本上治疗1型糖尿病。
血液系统疾病:造血干细胞移植已是治疗白血病、再生障碍性贫血等的标准方案。
产业脉络——从科学发现到商业模式的探索
干细胞产业的发展史,是一部不断突破科学瓶颈并寻找可持续商业模式的创新史。
2.1 科学奠基与道路选择
1966年间充质干细胞的发现并未立即引发热潮,直至上世纪90年代其潜能被系统揭示。当胚胎干细胞研究因伦理陷入僵局时,间充质干细胞因其可自体获取、无伦理争议且具有多重功能,成为一条全新的“绝佳道路”,全球研究自此进入快车道。
2.2 自体疗法的困境与异体“现货型”模式的崛起
2011年,全球首款自体骨髓干细胞药物在韩国获批,标志着干细胞治疗的正式上市。然而,自体疗法存在制备周期长(通常需数周)、患者依从性差(需经历穿刺取材)、成本高昂且无法规模化生产等根本性缺陷,使其只能作为一种高端个体化医疗技术,难以普及。
行业迅速将目光转向 “现货型”异体干细胞产品。这种模式提前从健康供体(如脐带、胎盘)中提取、扩增并冻干细胞,形成标准化药品库存,患者可即取即用。
2012年,全球首款异体干细胞药物在加拿大获批。该模式解决了规模化、标准化和即时性的核心痛点,真正让干细胞具备了成为“药品”的属性,吸引了拜耳、礼来等跨国药企巨资布局,产业化的序幕就此拉开。
中国路径——政策破冰与市场爆发
中国干细胞行业经历了从无序到规范、从谨慎到鼓励的清晰演变,独特的“双轨制”管理塑造了今天的繁荣局面。
3.1 监管框架的建立与“双轨制”创新
2015年以前,国内干细胞治疗一度处于模糊地带。2015年,国家卫计委与药监局联合发布《干细胞临床研究管理办法(试行)》,标志着监管从“第三类医疗技术”向 “药物” 管理模式转变。
此后形成的 “双轨制” 成为中国特色的管理创新:企业既可按照医疗技术路径在国家卫健委备案开展临床研究,也可按照药品注册路径向国家药监局申报新药临床试验,这一机制为创新提供了灵活通道。
3.2 制度化新阶段与成果井喷
2021年,监管部门明确干细胞制剂具有“药品属性”。2025年,《生物医学新技术临床研究和临床转化应用管理条例》作为国务院行政法规出台,标志着行业进入 全国统一、制度化的治理新阶段。
政策红利直接驱动产业爆发:2018年至2025年,CDE共受理215款干细胞新药临床试验申请,其中167款获准进入临床。尤其在2025年,受理数量同比激增119%,并附条件批准了我国首个间充质干细胞治疗药物(艾米迈托赛注射液),实现了“零的突破”。
3.3 蓬勃的市场前景
据预测,2024年全球干细胞市场规模已超150亿美元,并以超过11%的年复合增长率扩张,2034年有望突破450亿美元。其中,中国市场增速领跑全球,预计2026年市场规模将达325亿美元。
海南博鳌乐城、北京大兴机场自贸区等“先行先试区”的政策优势,正加速海外前沿疗法与国内产业的融合。
核心挑战——产业化道路上的科学与工程难题
尽管前景光明,但干细胞治疗要成为普惠医疗手段,仍需攻克一系列科学和工程化挑战。
4.1 细胞的“质控”与异质性
不同组织来源、供体年龄、健康状况的干细胞,其增殖能力、分化倾向和疗效存在显著差异,即 “功能异质性”。iPSC在重编程过程中也可能引入变异,如何建立统一的质量评判标准和规模化生产工艺,是保证产品批次间一致性的首要难题。
4.2 安全性与长期风险
免疫原性:异体干细胞虽免疫原性较低,但并非完全“免疫豁免”,仍有发生排斥的风险。
致瘤风险:尤其是具有无限增殖潜能的iPSC及其衍生产品,若移植细胞中混有未完全分化的细胞,可能存在形成畸胎瘤的风险。
非预期分化:移植后的干细胞在复杂体内微环境中,是否能稳定地分化为目标细胞而不“误入歧途”,仍需长期验证。
4.3 递送与存活效率的“瓶颈”静脉回输的干细胞绝大部分会被肺毛细血管截留,真正到达病灶的细胞寥寥无几,且存活时间短。如何提高细胞的 “归巢”能力、开发新型递送技术(如生物材料支架、靶向修饰),并优化移植策略,是提高疗效的关键。
应用纵深——从血液疾病到多系统攻坚
当前,干细胞临床应用呈现“根基稳固、多点开花”的态势。
5.1 成熟与支柱领域
造血干细胞移植治疗血液肿瘤及遗传性血液病已是成熟技术。同时,间充质干细胞在免疫调节方面的应用成为近期商业化突破点,中、美批准的首款MSC药物均用于治疗急性移植物抗宿主病。
5.2 快速扩张的临床前线
研究最活跃的领域集中在:
运动系统:治疗膝骨关节炎的干细胞注射液已进入III期临床,距上市最近。
消化系统:针对克罗恩病复杂性肛瘘的干细胞疗法同样进入III期。
神经系统:这是创新竞争最激烈的赛道。针对帕金森病、脊髓损伤、肌萎缩侧索硬化症等的多种干细胞产品已进入I/II期临床,其中iPSC衍生细胞疗法代表了技术前沿。
5.3 未来的“明星”赛道代谢性疾病,特别是1型糖尿病的功能性治愈,是国际竞争的焦点。国内已有企业开发的异体再生胰岛产品获得临床试验默示许可,并在探索性临床研究中展现出显著疗效,代表了该领域的全球领先水平。
竞争格局——群雄并起的产业生态全景
中国干细胞产业已形成从上游存储、中游研发到下游临床应用的完整链条,参与者多元且充满活力。
6.1 全产业链布局的上市公司与传统药企
这类企业凭借资本和资源整合优势,进行全产业链或重点领域布局。
中源协和:国内干细胞存储的龙头企业,同时积极向下游药物研发延伸,其治疗克罗恩病肛瘘的VUM03注射液已获临床受理。
九芝堂:老牌药企转型创新的代表,其引进的骨髓间充质干细胞项目分别针对急性脑卒中和肺泡蛋白沉积症,已获临床试验批准。
天士力:在心血管领域深度布局,其治疗慢性心力衰竭的脐带间充质干细胞注射液已获批临床。
北科生物、汉氏联合、博雅干细胞:均是行业早期开拓者,北科生物在红斑狼疮药物研发上取得进展;汉氏联合构建了集存储、研发、CDMO于一体的平台;博雅干细胞则在胎盘干细胞存储市场占据领先地位,并推动骨关节炎药物进入临床。
6.2 专注技术创新的生物科技公司
这是行业中最活跃的群体,聚焦于前沿技术平台和管线开发。
间充质干细胞方向:
泽辉生物:专注于胚胎干细胞来源的细胞治疗产品,其核心管线ZH901是国内首个进入II期临床的hESC来源细胞治疗产品。
茵冠生物:拥有多条间充质干细胞管线,其中治疗急性脑卒中的产品已进入II期临床。
诱导多能干细胞方向:该领域集聚了最多资本与关注,竞争全球领先地位。
士泽生物:致力于开发“现货型”iPSC衍生细胞药,用于帕金森病、渐冻症等重大神经系统疾病,其产品已获得中美多项临床试验批件。
睿健医药:独创“AI+化学诱导”平台,其iPSC来源的多巴胺前体细胞治疗帕金森病的产品已进入II期临床,并获FDA快速通道资格。
跃赛生物:其帕金森病自体iPSC治疗项目实现了中美双报双批,并正在开展注册临床试验。
霍德生物:以自主研发的神经分化技术为核心,建立iPSC细胞治疗平台,管线处于临床前阶段。
中盛溯源:由iPSC领域知名科学家创立,拥有国内领先的临床级iPSC细胞库,并围绕iPSC开发了涵盖神经、骨关节、免疫细胞的多条管线。
智新浩正:在糖尿病治疗领域取得突破,其“再生胰岛”产品是国内首款获批临床试验的异体通用型再生胰岛产品,技术路径国际领先。
瑞普晨创:专注于糖尿病再生治疗,其采用“化学重编程iPSC+定向分化”技术路线的胰岛细胞注射液已进入I期临床。
河络新图:打造iPSC定向分化平台,专注于开发iPSC来源的NK细胞、血小板等通用型细胞治疗产品。
吉美瑞生:深耕肺、肾等器官的前体细胞再生医学,其肺前体细胞药物已进入II期临床。
血霁生物:聚焦于血小板疾病,其干细胞疗法已获得FDA儿科罕见病认定。
星赛瑞真:平台型公司,通过引进与自研,布局iPSC衍生角膜内皮细胞、胰岛细胞等管线。
6.3 新兴的初创企业
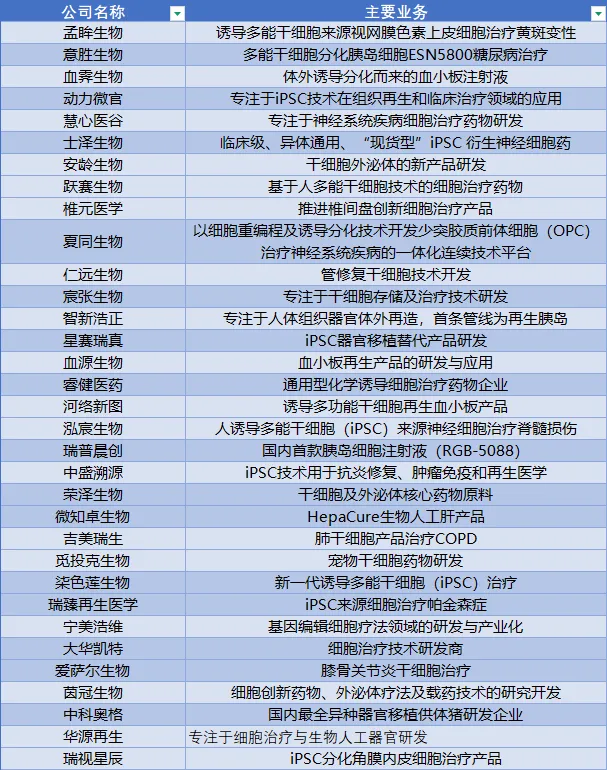
资本市场持续注入活水,孕育了一批聚焦更细分技术的新锐力量。如孟眸生物(视网膜疾病)、意胜生物(胰岛细胞)、动力微官(“干细胞+3D支架”微器官)、慧心医谷(诱导神经干细胞)、夏同生物(神经脱髓鞘疾病)、仁远生物(血管修复)、椎元医学(成纤维细胞治疗椎间盘退变)等。它们代表了行业技术路线的多元化和前沿探索的活力。
未来趋势——技术融合与产业融合
干细胞治疗的未来,将呈现技术突破与产业深化并行的趋势。
7.1 技术发展的核心方向
“现货型”异体治疗成为绝对主流:因其成本、规模化和便利性优势,将成为市场扩张的核心引擎。
iPSC技术走向舞台中央:随着定向分化效率提升、致瘤风险控制工艺成熟,iPSC将解决细胞来源的根本问题,催生新一代标准化细胞药物。
多技术融合催生突破:
基因编辑:与干细胞结合,可纠正患者细胞的基因缺陷,或增强干细胞的治疗特性。
3D生物打印与类器官:结合干细胞,实现复杂组织甚至微器官的构建,推动再生医学向器官修复迈进。
人工智能:应用于细胞质量自动监控、分化方案优化、疗效预测等,提升研发和生产效率。
新型递送系统:开发更智能的生物材料支架和靶向递送技术,提高细胞移植的精准度和存活率。
7.2 产业与市场演进
适应症持续拓宽:从当前相对集中的领域,向更广阔的自身免疫病、衰老相关疾病、生殖健康等领域深入。
支付体系与可及性探索:随着更多产品上市,如何纳入医保、商保,创新支付模式,将成为影响市场渗透率的关键。
全球化竞争与合作:中国企业凭借在部分领域的领先临床进展,正积极参与全球竞争,通过license-out(授权出海)等方式融入国际产业链。
结语
干细胞治疗行业已跨越了概念验证的萌芽期,正处于产业化突破的黎明。科学的持续进步、政策的明确引导、资本的密集投入以及企业的创新活力,共同构成了行业发展的强劲动力。
尽管在标准化、安全性和递送效率等方面仍面临挑战,但清晰的技术路径和巨大的临床需求预示着不可逆转的发展趋势。
未来十年,我们将见证一批革命性的干细胞产品上市,真正开启以“修复与再生”为核心的医疗新纪元。在这一历史进程中,兼具深厚科学积累、强大工程化能力和清晰商业策略的企业,将最有可能脱颖而出,成为行业的领导者。
注:药圈时汇也储备了多个干细胞相关的项目,借着政策的东方,助力企业发展,如感兴趣,请联系Luna_jake
声明:本篇文章系整理所得,旨在传播医药行业相关资讯,不做商用,内容版权归药圈时汇所有,欢迎个人转发分享。其他任何媒体、网站如需转载或引用请联系公众号获得授权,并在醒目位置处注明“转自:药圈时汇”。

●细分行业研究集合:CGT、合成生物、mRNA、疫苗等热门领域
药圈时汇是由在医药健康、券商基金、产业园区等领域从业者发起的自媒体交流平台,致力于为项目与资本方提供项目路演、资本交流、行业资讯等相关服务,如有合作意向或者项目的投融资需求,请联系Luna_jake

喜欢文章,顺手“三连”吧


