1. 前言:止血与血栓遗传学的基因组学范式转移
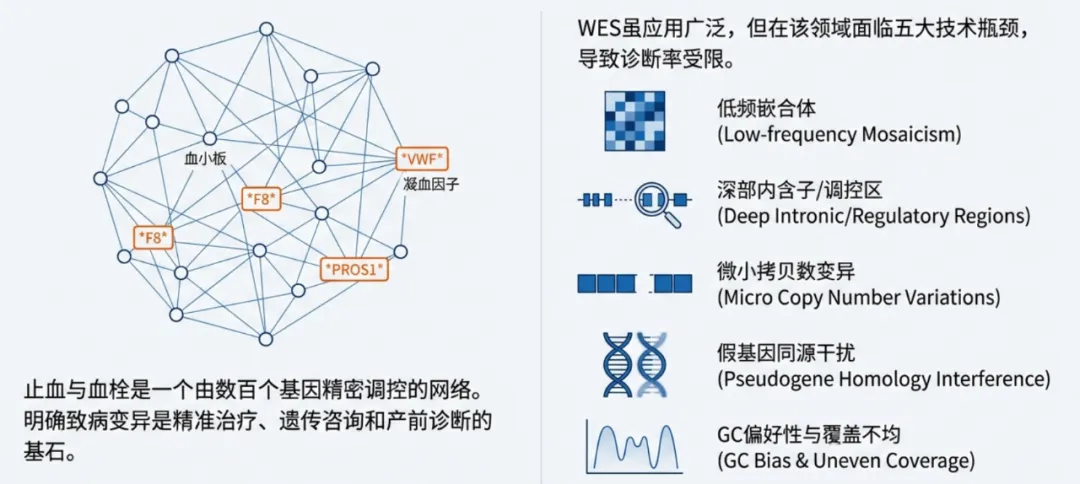
止血与血栓形成(Hemostasis and Thrombosis)是一个高度精密调控的生理网络,涉及内皮、血小板、凝血因子、抗凝蛋白及纤溶系统的动态平衡。这一系统的失调将导致出血性疾病(如血友病、血管性血友病)或血栓性疾病(如静脉血栓栓塞症VTE、血栓性微血管病TMA)。随着分子遗传学的进步,已识别出数百个与上述病理过程相关的基因。在临床诊断中,明确致病变异不仅是确诊的金标准,更是指导个体化治疗(如抗凝时长、基因治疗资格评估)、遗传咨询的基石 。
长期以来,Sanger测序曾是基因诊断的“金标准”,但其通量低、成本高,难以应对大基因(如VWF, F8)或多基因疾病的筛查需求。二代测序(Next-Generation Sequencing, NGS)技术的普及彻底改变了这一局面。目前,临床主流的NGS策略主要分为全外显子组测序(Whole Exome Sequencing, WES)和目标区域超深度测序(Targeted High-Depth NGS, HD-NGS)。
WES通常覆盖基因组中约1-2%的蛋白编码区,平均测序深度一般在100x-200x之间,被视为一种“广撒网”的策略,适用于表型复杂、致病基因不明的疑难杂症 3。然而,在血栓与止血这一特定垂直领域,致病基因相对明确,但其基因组结构却异常复杂——普遍存在假基因干扰(Pseudogenes)、高GC含量区域、复杂的拷贝数变异(CNV)、深部内含子变异(Deep Intronic Variants)以及体细胞/生殖细胞嵌合体(Mosaicism)实现复杂特定垂直领域,我们采用HD-NGS(如241个核心基因-出凝血全系统基因)突破在低频嵌合体、内含子致病位点、微小CNV及假基因同源区段检测中的技术瓶颈,从而显著提升临床诊断率。

2. 技术架构对比:测序深度与覆盖均一性的决定性作用
2.1 测序深度的统计学意义:从200x到1500x的质变
测序深度(Sequencing Depth)是指特定碱基被测序读取的次数。它直接决定了变异检测的置信度,特别是在等位基因频率(Variant Allele Frequency, VAF)偏离标准的50%(杂合)或100%(纯合)时。
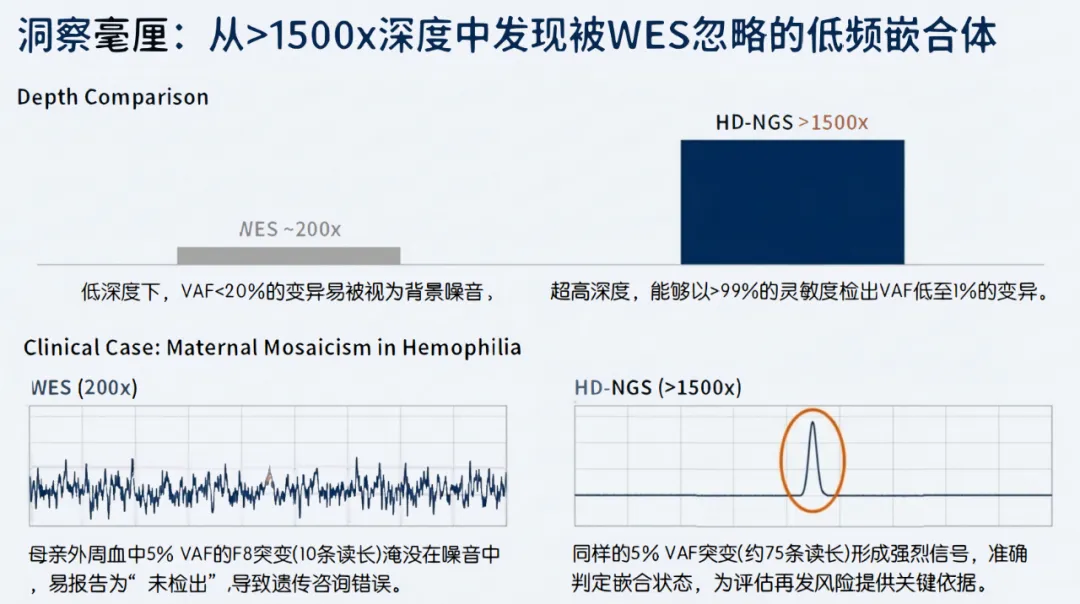
●WES(200x)的局限性:临床WES通常追求约100x-200x的平均深度。根据泊松分布(Poisson distribution),在平均深度100x的情况下,仍有相当比例的区域深度可能低于20x,这被称为“覆盖盲区”(Drop-out)。对于生殖系变异,通常要求至少20x-30x的深度来可靠地探寻杂合变异。然而,这一深度对于识别低频变异(<20% VAF)或进行精确的CNV定量分析是远远不够的 5。
●HD-NGS(>1500x)的优势:HD-NGS通过富集特定的Panel,将测序资源集中,使目标区域的平均深度超过1500x。超高深度并非简单的冗余,而是为了:
1.捕捉极低频变异:能够以>99%的灵敏度检测出VAF低至1%的嵌合体变异 7。
2.CNV的数字化定量:高深度将读取计数(Read Count)转化为高精度的数字信号,使得单外显子级别的缺失或重复在统计上变得显著,克服了WES数据的背景噪声 9。
3.克服捕获效率:即使在捕获效率较低的区域,极高的基数也能保证最终获得的有效数据量满足诊断要求 10。
2.2 覆盖均一性与GC偏好性挑战
血栓与止血相关基因中,许多关键基因的启动子区或第一外显子具有极高的GC含量(GC-rich),例如F8、PROS1、ADAMTS13及GP1BA等 11。
●WES的捕获偏差:WES使用的全基因组杂交探针库在GC含量极高或极低的区域杂交效率显著下降。研究表明,WES在GC含量>65%的区域覆盖度会急剧下降,导致以ADAMTS13第一外显子为代表的关键区域经常出现测序空白 14。这种系统性的覆盖不均是WES漏检的重要原因。
●HD-NGS的优化策略:针对241个特定基因设计的HD-NGS panel,针对高GC区域采用“平铺”探针(Tiling Probes)及增加探针密度(Spiking)。从而显著提升高GC区域的覆盖均一性,确保如PROS1启动子区等调控序列被完整测序 10。
表 1:WES与HD-NGS在血栓止血基因检测中的技术参数对比
比较维度 | 遗传WES (200x) | 遗传HD-NGS (>1500x) | 临床影响 (Clinical Impact) |
目标区域 | ~20,000基因 (仅编码区) | 241核心基因 (全外显子+内含子+调控区) | HD-NGS更聚焦,减少VUS,提升相关基因诊断深度。 |
平均深度 | ~100x - 200x | >1500x | HD-NGS支持嵌合体检测及高精度CNV分析。 |
GC区覆盖 | 差,易出现Drop-out | 优,通过探针优化和湿实验调整 | 避免ADAMTS13, F8等启动子等关键区域漏检。 |
内含子覆盖 | 仅覆盖外显子旁侧±10-20bp | 覆盖深部内含子致病区域 | 能够检出导致剪接异常的深部内含子变异。 |
CNV分辨率 | 基因级 (3个以上外显子) | 外显子级 (单外显子缺失) | 精确诊断如PROS1的微小缺失。 |
假基因分辨 | 差,依赖比对算法,易错配 | 强,结合特异性探针 | 解决VWFexon26、 PROS1等假基因干扰。 |
3. 嵌合体(Mosaicism)检测:突破遗传病的“全或无”认知
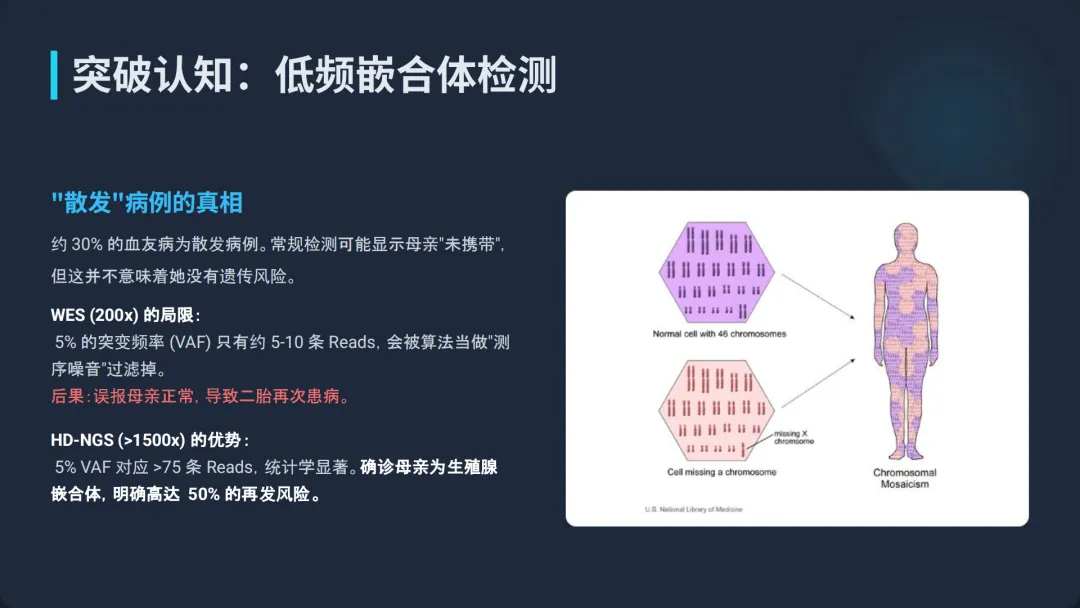
嵌合体现象,即在一个体中同时存在两种或多种基因型的细胞系,是导致“散发性”血栓与止血疾病的重要机制。传统的遗传检测假设变异为生殖系来源(VAF~50%),往往忽略了低频嵌合体,导致诊断遗漏或误判复发风险。HD-NGS凭借超高深度,成为检测此类变异的唯一可靠手段。
3.1 血友病(F8 / F9)中的母源嵌合体
血友病A(F8)和血友病B(F9)中,约30%的病例为散发性(无家族史)。研究表明,在这些散发病例的母亲中,相当一部分并非全身性的携带者,而是生殖或体细胞嵌合体17。
●WES的盲区:在WES的100x-200x深度下,若母亲外周血中的突变VAF为2%-5%,测序仪可能仅捕获到2-5条突变读长(Reads)。生物信息学算法通常会将此视为测序错误(Sequencing Error)或背景噪声而过滤掉,从而报告“未检测到变异”。这将导致遗传咨询错误,误认为母亲不携带突变,再发风险低。
●HD-NGS的洞察力:在>1500x的深度下,5%的VAF意味着约75条支持突变的Reads,这在统计学上是一个极其显著的信号,远超背景噪声(通常<0.1%)。HD-NGS能够精确识别低至0.5%-1%的低频变异,从而准确判定母亲的嵌合状态,正确评估再次妊娠生育患儿的风险(该风险可能高达50%) 7。
3.2 血管性血友病(VWF)与其它凝血因子的体细胞变异
除了生殖系嵌合,体细胞嵌合体也可能导致表型与基因型的不匹配。
●2N型VWD:有报道显示,某些2N型VWD或轻型血友病患者,其致病变异可能呈现体细胞嵌合状态。例如,肝脏(合成凝血因子的主要器官)可能携带较高比例的突变细胞,而外周血(检测样本)中的比例较低。WES极易漏检外周血中的低频变异,而HD-NGS则能捕捉到这些微弱的遗传痕迹,解释患者“不明原因”的凝血因子活性降低 21。本中心已发现几个病例为体细胞嵌合VWF。
●PROS1缺陷:文献报道了蛋白S缺乏症中的父源嵌合体案例,父亲虽无症状,但其生殖细胞及部分体细胞携带PROS1突变,导致子代患病。HD-NGS对于此类隐匿性遗传来源的排查至关重要 22。
深度洞察:在血栓与止血领域,HD-NGS不仅是一种检测技术的升级,更是一种诊断思维的革新。它提示临床医生,阴性的常规检测结果并不代表“无基因异常”,HD-NGS应作为排除低频嵌合体的必要手段。
4. 深部内含子变异(Deep Intronic Variants):照亮基因组的“暗物质”
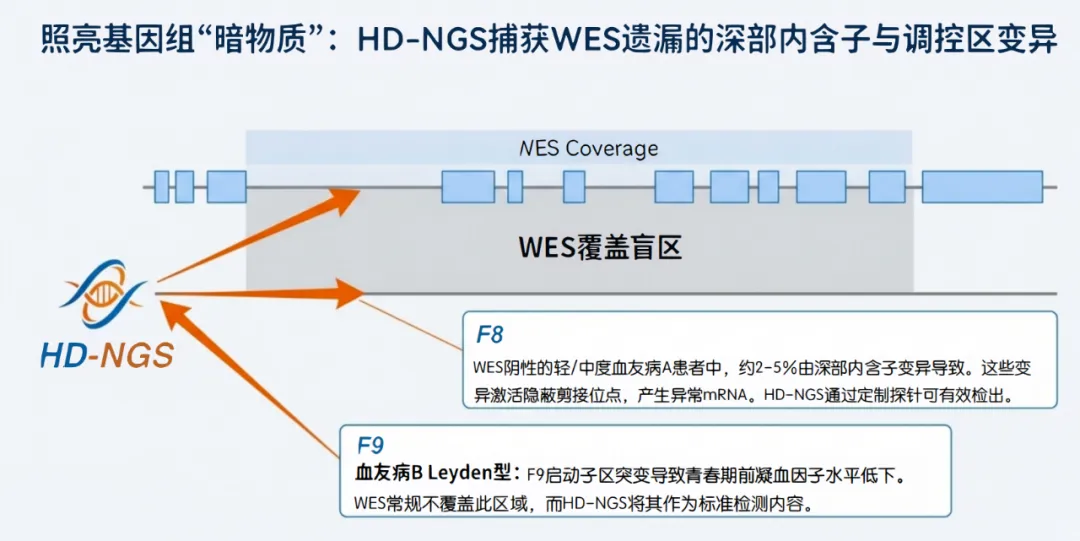
WES的设计初衷是捕获编码区(Exome),其探针通常仅覆盖外显子及其侧翼10-20bp的区域。然而,越来越多的证据表明,位于内含子深处的变异通过破坏剪接调控元件(如分支点、增强子)或创造隐蔽剪接位点(Cryptic Splice Sites),导致假外显子(Pseudo-exon)插入,从而引发严重的凝血功能障碍 2。
4.1 F8基因的深部内含子突变
F8基因极其庞大(186kb),内含子序列极长。WES完全忽略了这些区域。
●致病机制:特定的深部内含子突变,如c.2113+601G>A(内含子13)或c.5220-8563A>G(内含子14),能够激活隐蔽的剪接供体或受体位点,导致一段内含子序列被错误地保留在mRNA中(假外显子),引起移码突变或提前终止 25。
●HD-NGS解决方案:针对F8的HD-NGS“平铺”探针覆盖关键内含子区域,或者针对已知的深部致病热点进行定点捕获。研究显示,在WES检测阴性的轻/中度血友病A患者中,通过全基因组或针对性内含子测序,可检出约2%-5%的病例为深部内含子变异所致 27。
4.2 VWF与PROS1的隐匿突变
●VWF:在表型明确为3型VWD但常规外显子测序阴性的患者中,HD-NGS结合RNA分析揭示了如内含子(c.997+118T>G)等深部变异,这些变异破坏了正常的剪接过程,导致蛋白表达完全缺失 29。
●PROS1:PROS1基因的内含子变异也是蛋白S缺乏症漏诊的重要原因。HD-NGS panel的灵活性允许包含这些非编码区的致病位点,而WES受限于固定的捕获试剂盒,无法灵活添加这些区域 12。
4.3 启动子与调控区变异
除内含子外,基因的启动子区变异也常被WES遗漏。
●血友病B Leyden:由F9启动子区的点突变引起(如c.-20, c.-26等),破坏了雄激素受体(AR)或肝细胞核因子(HNF4α)的结合位点,导致儿童期因子IX水平极低,而青春期后随雄激素水平升高而缓解。WES捕获范围通常不包括转录起始位点上游的启动子区,而HD-NGS panel则将此区域作为F9检测的标配 32。
●F7启动子:F7基因启动子多态性(如rs3093230)显著影响FVII的血浆水平,HD-NGS能够完整评估这些调控位点,辅助判断FVII缺乏的临床意义 33。
5. 拷贝数变异(CNV)的精准解析:从基因级到外显子级
CNV(大片段缺失或重复)是SERPINC1、PROS1、F8等基因功能丧失的重要机制。WES在CNV检测上存在天然劣势,而HD-NGS通过高深度和均一性覆盖实现了CNV检测的“标准化”。
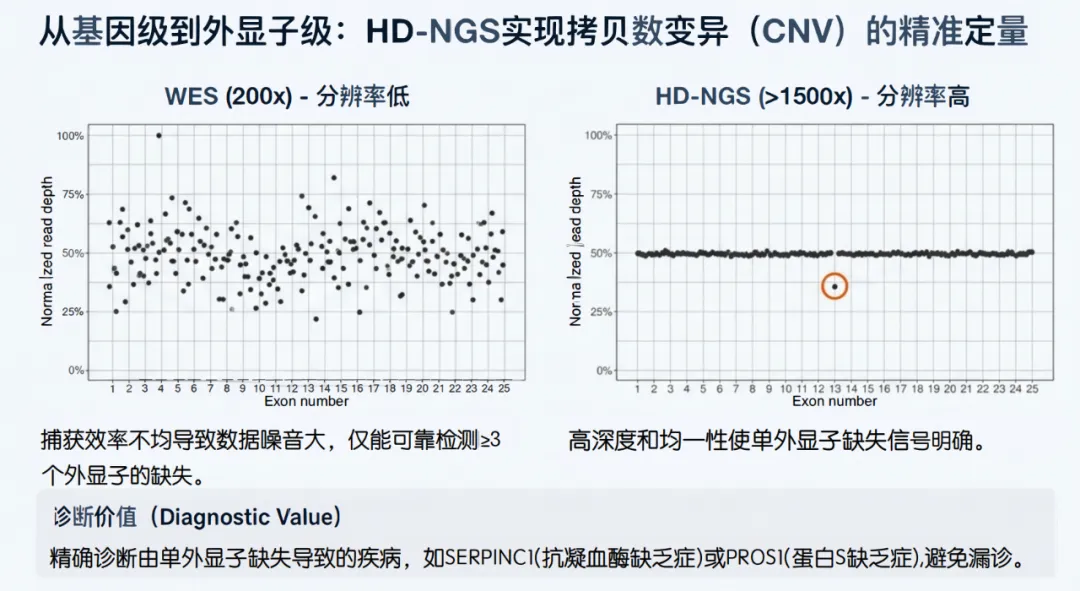
5.1 均一性带来的分辨率提升
●WES的噪声:WES由于捕获效率在不同外显子间差异巨大(受GC含量、探针亲和力影响),其读深度的变异系数(CV)较大。这使得基于深度比较的CNV算法难以区分真实的“杂合缺失(50%深度下降)”与“捕获效率低下的波动”。通常WES只能可靠地检测涉及3个或更多连续外显子的大CNV 34。
●HD-NGS的精度:HD-NGS经过探针平衡优化,不同外显子间的深度更加均一。在>1500x的深度下,读数统计非常稳健,算法可以敏锐地捕捉到单个外显子(Single-Exon)级别的深度变化(如从1500x降至750x),其灵敏度和特异性均较高 9。
5.2 关键基因的CNV诊断价值
●SERPINC1(抗凝血酶):抗凝血酶缺乏症I型患者中,大片段缺失较为常见。特别是单外显子缺失(如Exon 1或Exon 6的独立缺失),在WES数据中常被淹没在噪声中,导致漏诊。HD-NGS不仅能检出这些微小CNV,还能通过断点分析识别复杂的结构变异 37。
●PROS1(蛋白S):PROS1的大片段缺失也是重要致病原因。由于PROS1P假基因的存在,WES难以准确评估PROS1的拷贝数。HD-NGS通过针对性设计避开假基因干扰,能够准确进行PROS1的剂量分析 40。
●F8与F9:对于血友病携带者,杂合的大片段缺失在常规PCR中无法显示(因为由于X染色体失活或另一条X染色体的掩盖),必须依赖定量的CNV分析。HD-NGS提供的一站式CNV检测能力,避免了后续追加MLPA检测的繁琐和成本 42。
6. 攻克基因组“雷区”:假基因与高同源序列的解析
血栓与止血相关的241个基因中,包含多个具有高度同源假基因的“困难基因”。WES采用的短读长、通用捕获策略在此类区域极易发生比对错误(Mapping Errors),导致假阴性或假阳性。HD-NGS则通过特殊的实验设计和分析流程解决了这一难题。
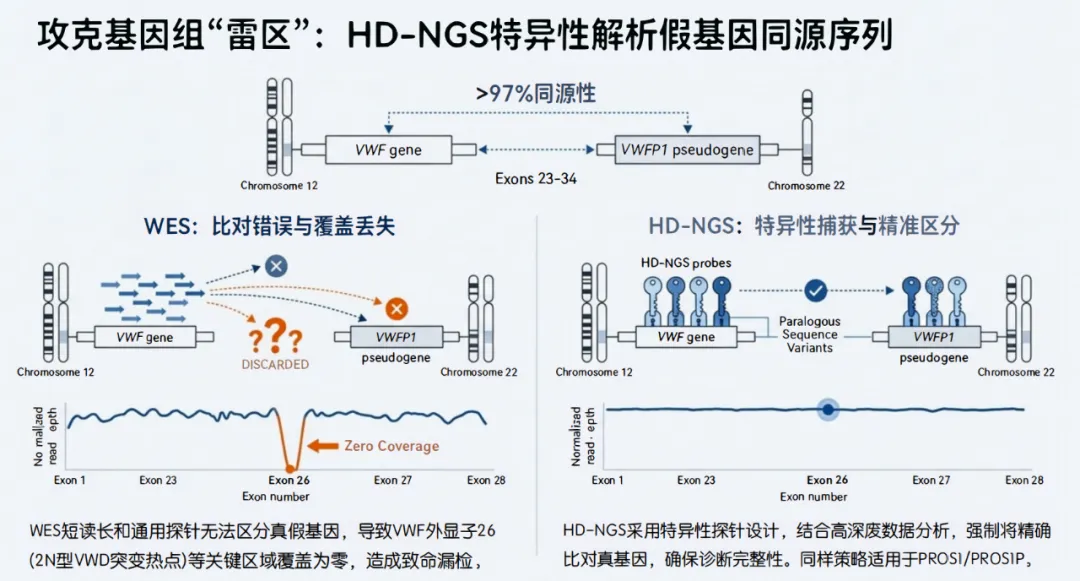
6.1 VWF 外显子26-34与假基因 VWFP1
●核心难题:VWF基因的外显子23-34与位于22号染色体上的假基因VWFP1具有高达97%的序列同源性。在WES数据中,源自VWF真基因的Reads常被错误比对到假基因上,或者因多重比对(Multi-mapping)被丢弃,导致外显子26等区域出现覆盖度极低甚至为零的现象(Drop-out)。外显子26是2N型VWD致病突变的热点区域,WES的这一缺陷是致命的 43。
●HD-NGS解决方案:特异性探针设计,针对真假基因间仅有的少量差异碱基(Paralogous Sequence Variants, PSVs)设计探针,并结合高深度测序数据的单体型分析,实现精准比对。
6.2 PKD1(多囊肾相关)的各种假基因
虽然PKD1主要导致多囊肾,但作为241基因列表中的一员,其与血栓风险及血管结构异常相关。PKD1外显子1-33与6个假基因(PKD1P1-P6)共享98%的同源性。
●WES的无力:WES在PKD1前33个外显子的检测灵敏度仅为约50%,大量变异被漏检或误判 46。
●HD-NGS的应对:必须采用LR-PCR结合HD-NGS,或者采用最新的长读长测序(如PacBio/Nanopore)技术整合到Panel中,才能准确解析这一区域。对于临床诊断,HD-NGS是目前的必选项 48。
6.3 PROS1与PROS1P
●PROS1的外显子1-5与假基因PROS1P高度同源。WES数据在此处常出现比对混乱,导致假阳性变异报告。HD-NGS通过深度测序和PSV分析,能有效区分真假基因,避免误诊 12。
6.4 HBA1 / HBA2(α-地中海贫血)
这两个基因不仅高度同源,还经常发生大片段缺失。WES捕获效率极低且无法准确定量。HD-NGS通过针对性的高深度覆盖下的剂量分析,能够准确诊断α-地贫携带者,这对于解释某些贫血或红细胞增多症至关重要 51。
6.5 CFH基因簇(aHUS相关)
CFH与CFHR1-5基因簇存在复杂的同源重组和杂合基因(Hybrid Genes,如CFH::CFHR1)。这种结构变异是aHUS的常见病因。WES难以识别这种融合基因。HD-NGS结合MLPA及结构变异分析算法,能更有效地识别此类复杂变异 53。
7. 241个基因的综合优势分析
HD-NGS的优势不仅体现在上述通用机制上,更体现在对特定基因的具体临床问题的解决能力上。

7.1 凝血因子类(F8, F9, F7, F12等)
●F8/F9:HD-NGS能解决高达5%的“基因型阴性”血友病患者的诊断问题,这些患者多为深部内含子变异或母亲低频嵌合体。对于F9,HD-NGS能覆盖启动子区,检出血友病B Leyden型突变(WES常漏检启动子) 32。
●F7:启动子多态性(如rs6046)对FVII活性影响显著,HD-NGS的完整覆盖有助于解释表型与基因型的相关性 33。
●F12:HD-NGS的高深度有助于准确识别与HAE-FXII相关的特定缺失突变(p.Phe368_Leu369del)及GOF突变,避免因覆盖不均导致的漏检 1。
7.2 抗凝蛋白类(SERPINC1, PROS1, PROC)
●SERPINC1:单外显子缺失是Type I缺陷的重要原因,HD-NGS的CNV分析能力至关重要。此外,启动子区变异(如c.-42-1056G>A)也能被有效捕获 38。
●PROS1:通过高深度和特异性探针设计,HD-NGS是目前解决PROS1假基因干扰、实现准确分子诊断的首选NGS方法 61。
7.3 血小板疾病类(GP1BA, MYH9, ITGA2B, ITGB3)
●GP1BA:该基因含有一个富含串联重复序列(VNTR)的区域(Macroglycopeptide region),WES常导致覆盖度归零或比对错误。HD-NGS配合专门的VNTR分析算法(如adVNTR)及读长策略,能准确解析该区域的变异,这对于诊断Bernard-Soulier综合征和血小板型VWD至关重要 62。
●MYH9:大基因,突变位点分散。HD-NGS的高覆盖确保了对所有外显子及剪接位点的无死角检测,包括可能导致剪接异常的非经典位点变异。
7.4 TMA与补体类(ADAMTS13, CFH)
●ADAMTS13:由于GC含量高,WES常在Exon 1等区域出现覆盖低谷。HD-NGS通过优化的文库构建保证了全基因的均一覆盖,确保不漏检cTTP致病变异 10。
●CFH:HD-NGS结合CNV分析是解析CFH-CFHR1杂合基因及缺失的必要手段,这是aHUS诊断的核心部分 53。
7.5 药物基因组学与代谢类(VKORC1, CYP2C9, ABCB1)
●这些基因的变异多为SNP,虽然WES能检出,但HD-NGS的高深度提供了更准确的单倍型定相(Phasing)能力,有助于更精准地预测华法林或抗血小板药物的代谢表型 。
8. 临床效用、诊断率与成本效益分析
8.1 诊断率(Diagnostic Yield)
对于表型明确的出血或血栓性疾病,针对性的HD-NGS panel的诊断率通常优于或等同于WES。
●在血友病、VWD等疾病中,由于WES无法检测部内含子变异及部分CNV,其诊断率可能比HD-NGS低约5-10% 64。
●单基因病,Targeted Panel的覆盖度显著优于WES,对关键基因的诊断能力更强 66。
8.2 成本与时效
●成本:虽然WES测序成本在下降,但考虑到数据存储、复杂的生物信息学分析(需过滤数万个无关变异)以及对假阳性结果的Sanger验证成本,HD-NGS在特定临床场景下往往更具成本效益 68。
●时效:HD-NGS产生的数据量远小于WES,分析流程更快,报告时间更短,这对于急需确诊以长期指导治疗的患者至关重要(如遗传aHUS)68。
8.3 意外发现(Incidental Findings)
WES会产生大量与主诉无关的意外发现(如肿瘤易感基因),这带来了复杂的伦理和遗传咨询问题。HD-NGS仅聚焦于241个相关基因,大大简化了临床报告和咨询流程 70。

9. 结论与建议
综上所述,在血栓与止血遗传病的诊断中,遗传HD-NGS(>1500x)相较于遗传WES(200x)具有技术和临床优势。
1.覆盖完整性:HD-NGS有效解决了WES无法覆盖的深部内含子(F8, VWF)、启动子区(F9, F7)及高GC区域(ADAMTS13)。
2.复杂变异解析:HD-NGS是解析同源假基因(VWF Exon 26, PROS1, PKD1)和特殊重复序列(GP1BA VNTR)的必要手段。
3.灵敏度突破:>1500x的深度使得低频嵌合体(母亲携带者)和微小CNV(单外显子缺失)的检测成为可能,填补了WES的诊断盲区。
建议:对于临床怀疑患有血友病、VWD、血栓性疾病或血小板疾病的患者,首选基于HD-NGS的专病Panel进行检测。WES应仅作为HD-NGS检测阴性后,为了寻找未知新致病基因的二线科研性检测手段。对于241个明确关联的基因,HD-NGS代表了当前分子诊断的最精度与最佳实践。

基于以上讨论,以下为协助临床、患者获益的总结性 PDF,供临床研究者快速查阅、参考斧正