糖基化反应是普遍存在于食物加工储存过程中还原糖羰基和蛋白质游离氨基之间的羰氨缩合反应。糖基化产物会对细胞或人体产生多种危害。目前,人工合成的糖基化抑制剂氨基胍对非酶糖基化具有较好抑制效果,但其毒副作用强,临床上已禁止使用。槲皮素-3-O-葡萄糖苷(Q3G)是槲皮素的同系化合物,由于其葡萄糖苷部分α键的伸长使其生物利用度和安全性均优于芦丁及槲皮素。前期研究发现,Q3G通过与牛α-乳白蛋白(α-La)相互作用,改变其构象,显著减少AGEs的形成,然而,其抑制机制尚不明确,需要进一步的探究。江西师范大学生命科学学院的张露、徐林菊、涂宗财*等人以α-L a-果糖为糖基化模型,以Q3G为抑制剂,通过检测褐变程度和游离氨基、果糖胺、5-HMF等的含量,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析糖化导致的α-La交联,考察Q3G对非酶糖基化的抑制活性;然后,利用分子对接技术分析Q3G与α-La之间的相互作用关系,并运用超高效液相色谱-四极杆-静电场轨道离子阱串联质谱(UPLC-Q-Orbitrap MS/MS)技术探究Q3G对α-La糖基化位点的影响,旨在揭示Q3G对非酶糖基化的抑制机制。
美拉德反应诱导的糖基化主要发生在Lys残基的ε-氨基上,而在组氨酸的咪唑基团、色氨酸的吲哚基团、精氨酸(Arg)残基的胍基和蛋白质的N端上发生的程度较低,因此,Lys残基上游离氨基的数量可反映糖基化的程度。如图1所示,Q3G显著提高了糖基化过程中游离氨基的含量,呈现出剂量效应,且效果强于阳性对照品AG。当添加Q3G浓度为3 mmol/L时,体系中的游离氨基质量浓度最高,达0.693 mg/mL,约为控制组(0.521 mg/mL)的1.33 倍。以上结果表明Q3G阻止了α-La游离氨基参与糖基化反应,减缓了糖基化反应的进程,可能的原因是Q3G通过清除活性自由基减少了游离氨基的氧化。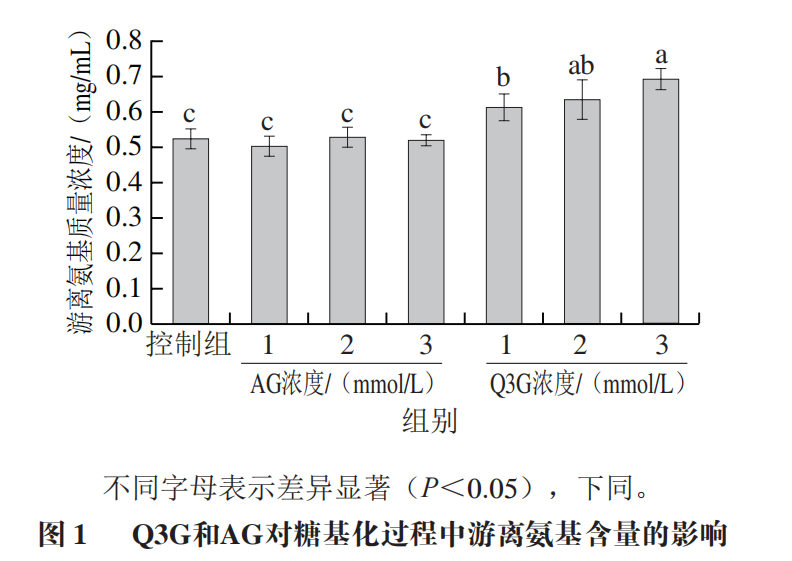
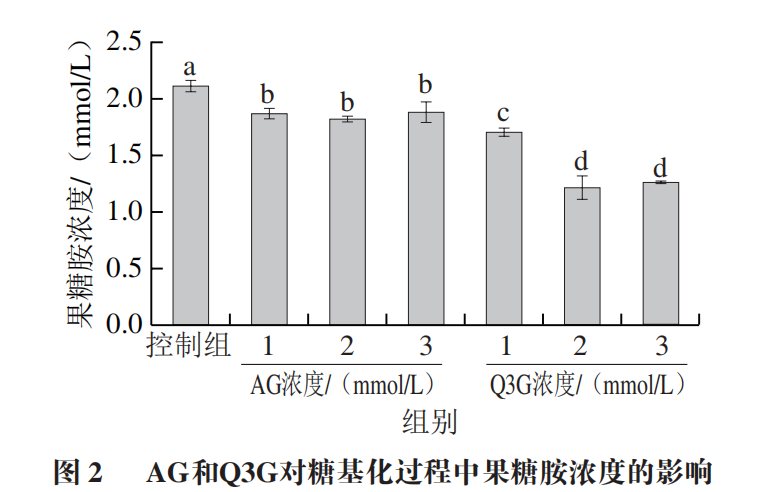
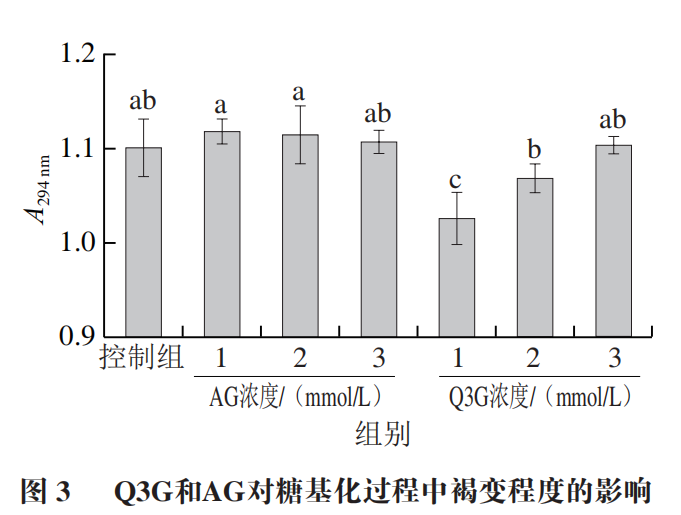
果糖胺是非酶糖基化早期标志物,通过测定其含量可考察Q3G对非酶糖基化早期反应的抑制能力。如图2所示,Q3G显著抑制了糖基化过程中果糖胺的形成,且存在浓度依赖性。当Q3G添加浓度为1、2 mmol/L和3 m m o l/L 时,果糖胺浓度分别为1.69、1.21、1.26 mmol/L,显著低于控制组(2.09 mmol/L)和AG组。同时,添加2 mmol/L与3 mmol/L Q3G的反应体系中果糖胺含量无显著差异,表明添加2 mmol/L的Q3G对果糖胺生成的抑制作用已达到峰值。以上结果表明Q3G能延缓糖基化早期反应的进程,这可能是由于Q3G参与螯合金属离子,降低了糖化蛋白的氧化作用;同时,Q3G可能通过与α-La形成络合物,影响了游离氨基对还原糖羰基的可及性,进而减少了果糖胺的形成。糖基化反应初期产物进一步裂解氧化,产生一系列小分子,这些小分子是褐色色素形成的主要前体物质,通过测定294 nm波长处的吸光度反映其含量,并体现样品褐变程度。如图3所示,控制组、添加1、2 mmol/L和3 mmol/L Q3G实验组的吸光度分别为1.1、1.026、1.096、1.104,Q3G的添加改变了反应体系在294 nm波长处的吸光度,含1 mmol/L Q3G实验组效果最好,其吸光度显著低于控制组;含3 mmol/L Q3G实验组的吸光度与控制组和3 mmol/L AG组(1.107)无显著差异。以上结果说明Q3G显著抑制了糖基化导致的褐变,这可能是由于Q3G通过自由基清除活性减缓了初期产物的氧化裂解。
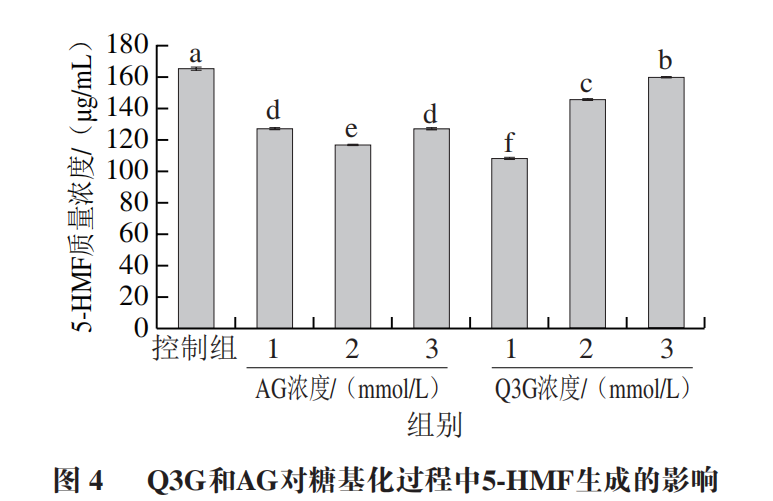
5-HMF是还原糖通过异构和脱水产生的呋喃化合物,是糖基化反应中期的标志性产物,如图4所示,添加1、2、3 mmol/L的Q3G后,体系中5-HMF质量浓度由165.28 μg/mL降至111.64、145.09 μg/mL和158.34 μg/mL;添加1 mmol/L Q3G的α-La-果糖糖基化体系中5-HMF含量最低,显著低于相同添加量的AG(116.26 μg/mL)。然而,随着Q3G浓度的升高,5-HMF含量呈现升高的趋势。当Q3G浓度低于2 mmol/L时,其能显著减少5-HMF的形成。此外,前期研究发现,当Q3G浓度为36.58 μmol/L时,其对AGEs的抑制率可达74.66%,表明Q3G能显著延缓晚期糖基化反应的进行,造成中期产物如5-HMF等的积累。
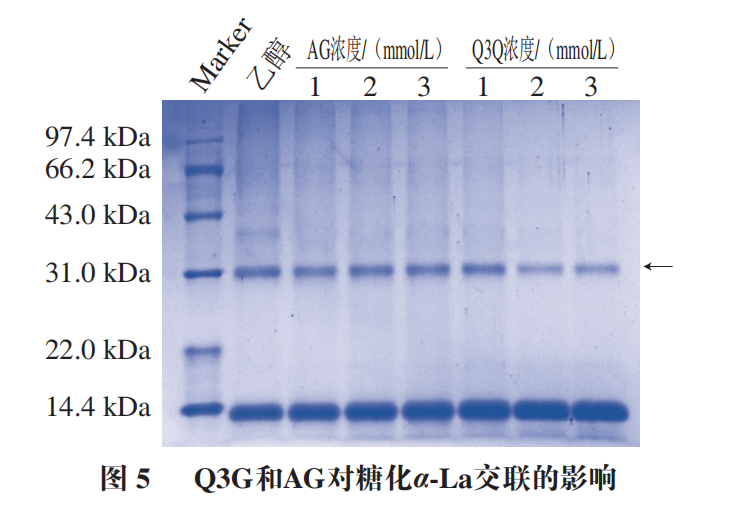
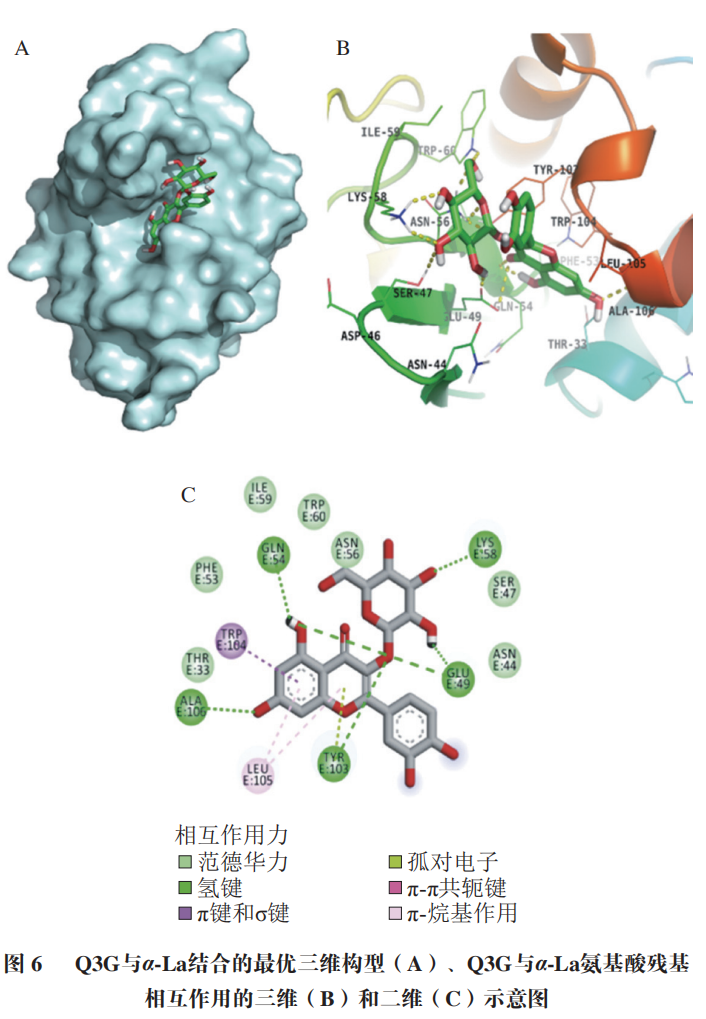
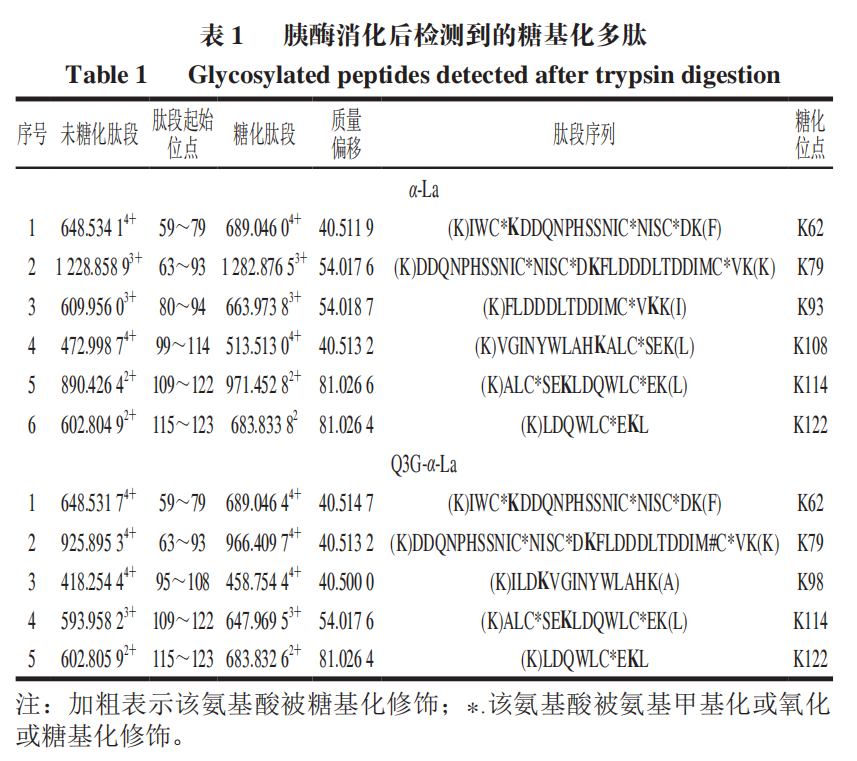
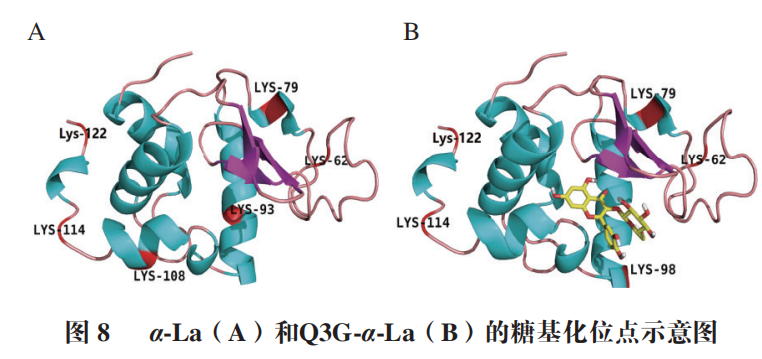
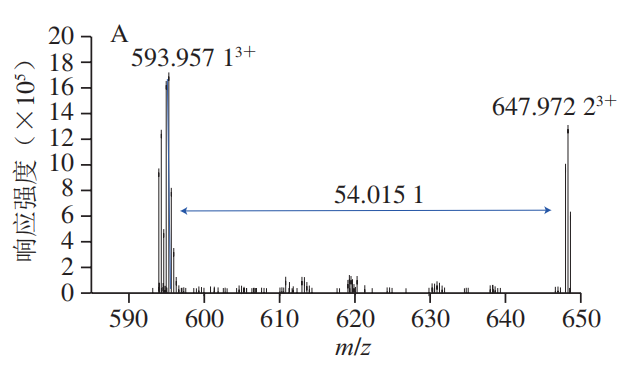
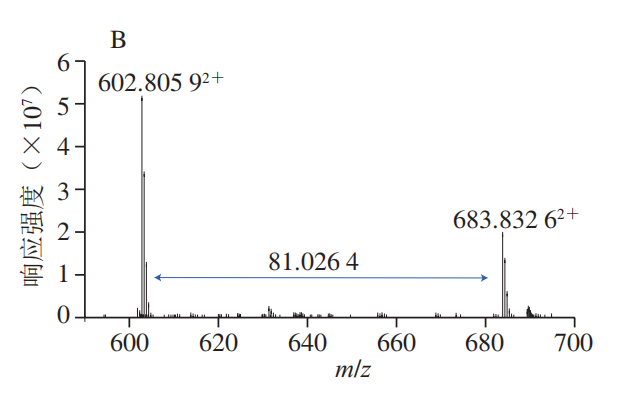
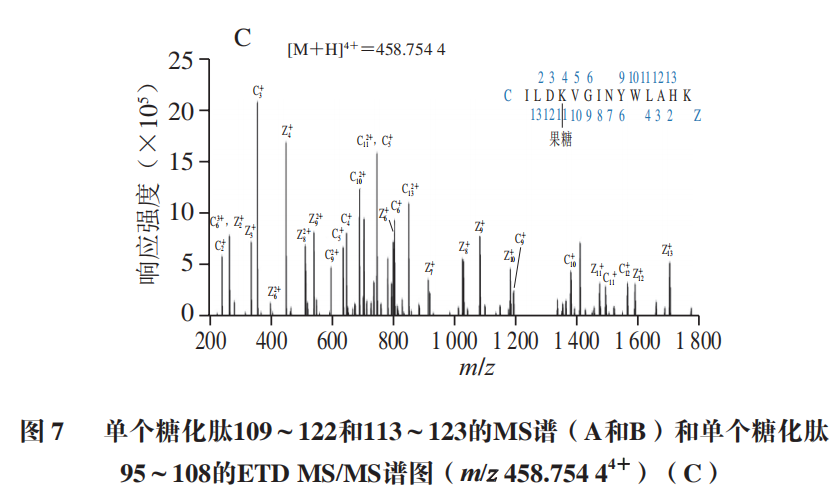
α-La由123 个氨基酸残基组成,分子质量大约为14.2 kDa,糖基化会导致蛋白质交联而使得其分子质量增大如图5所示,控制组在14.4 kDa略下方和31 kDa处各有一明显条带,表明糖基化会引发α-La的交联。添加Q3G之后,31 kDa处蛋白条带与控制组相比明显变浅,当Q3G浓度为2 mmol/L和3 mmol/L时,31 kDa处条带的颜色差异不明显,但显著浅于AG组。以上结果说明Q3G能抑制糖化导致的α-La交联,添加量为2 mmol/L时的抑制效果最好。分子对接常用于研究小分子化合物和蛋白的相互作用机制。经过100 次模拟之后,选用结合能量最低(-8.51 kcal/mol)最稳定的模型进行后续的分析(图6A)。从对接结果可以看出,Q3G可进入α-La的疏水口袋中,通过疏水作用力、范德华力和氢键与其氨基酸残基进行结合。由图6B、C可知,Q3G和α-La的氨基酸残基Glu49、Gln54、Lys58、Tyr103、Ala106形成了5 个氢键,与氨基酸残基Thr33、Asn44、Ser47、Phe53、Asn56、Ile59、Trp60形成了范德华力,并和氨基酸残基Trp104、Leu105形成疏水相互作用。Zhang Yuanyuan等也发现Ser-47、Glu-49、Gln-54、Asn-56、Tyr-103、Trp-104、Leu-105、Ala-106、Thr-33等氨基酸残基是α-La的活性位点。研究发现,小分子化合物受氢键、范德华力和疏水相互作用驱动,能自发与蛋白质形成稳定络合物,并影响其构象。因此,Q3G可能是通过与α-La的活性位点结合形成稳定的络合物,影响其空间结构变化,进而影响了果糖与α-La的反应,达到抑制糖基化的早、中和晚期产物形成的效果。为更好地阐明Q3G对α-La-果糖糖基化的抑制机制,采用UPLC-Q-Orbitrap MS/MS技术研究Q3G对α-La糖基化位点的影响。糖化的多肽可通过对比其糖化前后的质量偏移进行确定。Lys、Arg和N末端的氨基是蛋白质的潜在糖化位点,而胰酶不会破坏Lys、Arg的糖基化修饰,因此,将C系列和Z系列离子与已发现的蛋白质组中记录的离子匹配可对糖基化位点进行表征。果糖相对分子质量为180,当一分子果糖连接到Lys上时,C(n)和C(n-1)之间或Z(m-n)和Z(m-n+1)之间的质量偏移为162+128,而Arg为162+156(其中m为特定肽段中氨基酸残基的数目,n为Lys/Arg的位置)。当多肽所带电荷为+1、+2、+3、+4时,单糖基化肽段质荷比(Δm/z)分别增加162.0528、81.0264、54.0176和40.5132;而双糖基化肽段m/z分别增加324.1056、162.0528、108.0352和81.0264。如图7A、B所示,未糖基化肽段109~122(ALCSEKLDQWLCEK)和115~123(LDQWLCEKL)的m/z峰值分别为593.95713+和602.80592+,糖化之后其m/z分别增加了54.0116和81.0263,表明肽段109~122和115~123均被一分子果糖糖化。肽段95~108(ILDKVGINYWLAHK)的m/z由418.25444+增加至458.75444+,可推断该肽段结合了一分子果糖,Lys98和Lys108是其潜在的糖化位点,利用肽谱(图7C)分析发现,C4+的m/z为649,C3+的m/z为359,表明C4位(Lys98)发生糖基化。同理,C14或Z1位未发现相应规律,即Lys108不是糖基化位点。参照其鉴定规律,从添加Q3G前后糖化α-La中分别鉴定出6 个和5 个糖基化位点(表1)。已有研究证明,糖基化位点的增加和减少与黄酮化合物诱导蛋白质Lys残基周围的构象结构和微环境的变化有关。如图8所示,受影响的糖基化位点Lys108、Lys93和Lys98位于Q3G所在的疏水口袋内,说明Q3G可能通过稳定α-La构象并影响Lys残基的微环境,导致α-La的糖基化活性位点减少了一个,达到延缓糖基化进程和减少有害糖基化产物形成的效果。以Q3G为研究对象,通过构建α-La-果糖糖基化模型,考察Q3G的非酶糖基化抑制作用及其机制。结果发现,Q3G的添加能显著增加游离氨基含量,且3 mmol/L Q3G可将游离氨基质量浓度提高0.172 mg/mL。同时,Q3G能抑制果糖胺及5-HMF的产生,缓解糖基化导致的褐变及α-La交联;其中,2 mmol/L Q3G对果糖胺和交联α-La的抑制作用最佳。低浓度的Q3G对5-HMF和褐变程度的抑制效果最好,且随着Q3G浓度升高而有所减弱,但是Q3G抑制效果显著强于AG。另外,Q3G能缓解糖化α-La的交联,且添加量为2 mmol/L时效果最好。分子模拟研究发现Q3G能通过氢键、疏水相互作用和范德华力与α-La的活性氨基酸残基Glu49、Gln54、Lys58、Tyr103、Ala106、Thr33、Asn44、Ser47、Phe53、Asn56、Ile59、Trp60、Trp104、Leu105作用,改变其疏水口袋内的微环境,从而影响氨基酸残基与果糖的结合,抑制非酶糖基化反应。同时,UPLC-Q-Orbitrap MS/MS分析也发现Q3G屏蔽了α-La的糖基化位点Lys93和Lys108,新增了糖基化位点Lys98,达到延缓非酶糖基化和减少有害糖基化产物形成的效果。综上,Q3G具有很强的抗糖基化能力,可作为抗糖基化剂或者功能食品配料用于预防糖尿病并发症。然而,Q3G是否能够添加到食品中发挥抗糖化作用还有待进一步研究。下一步工作计划通过动物实验验证Q3G对体内AGEs形成的抑制效果以及对糖尿病并发症的预防作用。本文《槲皮素-3-O-葡萄糖苷抑制α-乳白蛋白非酶糖基化机制分析》来源于《食品科学》2023年44卷20期28-34页. 作者:张露,徐林菊,彭春彦,王佩欣,谢作桦,谢星,贾晓燕,涂宗财. DOI:10.7506/spkx1002-6630-20221004-027. 点击下方阅读原文即可查看文章相关信息。实习编辑:李雄;责任编辑:张睿梅。点击下方阅读原文即可查看全文。图片来源于文章原文及摄图网。
《食品科学》食品非热加工专栏:江西师范大刘俊副教授等:超声波预处理对小清蛋白半乳糖糖基化特性的影响
《食品科学》食品非热加工专栏:江苏大学邹小波、石吉勇教授等:米糠非热稳定化处理技术研究进展