FDA жӢ’з»қжү№еҮҶж—Ҙжң¬ SNBL ж——дёӢ Satsuma Pharmaceuticals з”ЁдәҺжІ»з–—жҖҘжҖ§еҒҸеӨҙз—ӣзҡ„еҸҢж°ўйәҰи§’иғәйј»зІүдә§е“Ғ STS101 дёҠеёӮгҖӮ
е®Ңж•ҙеӣһеә”еҮҪ (CRL) дёӯжҢҮеҮәдәҶ STS101 зҡ„еҢ–еӯҰгҖҒеҲ¶йҖ е’ҢжҺ§еҲ¶ (CMC) ж–№йқўзҡ„й—®йўҳгҖӮCRL жІЎжңүжҢҮеҮә STS101 жңүд»»дҪ•е®үе…Ёй—®йўҳпјҢд№ҹжІЎжңүиҰҒжұӮиҝӣиЎҢйўқеӨ–зҡ„з ”з©¶гҖӮ
Satsuma е°ҶдёҺ FDA и®Ёи®әжӢ’з»қдәӢе®ңпјҢд»ҘйҮҚж–°жҸҗдәӨдёҠеёӮз”іиҜ·гҖӮ
STS101 жҳҜйј»и…”з»ҷиҚҜеҒҸеӨҙз—ӣиҚҜзү©з”ІзЈәй…ёеҸҢж°ўйәҰи§’иғә (DHE) зҡ„йҮҚж–°й…ҚеҲ¶зүҲжң¬пјҢеҲ©з”Ё Satsuma зҡ„дё“жңүи®ҫеӨҮиҝӣиЎҢйҖ’йҖҒпјҢж•ҙдҪ“еҸӘжңүеҸЈзәўеӨ§е°ҸпјҢж–№дҫҝжҗәеёҰе’ҢдҪҝз”ЁгҖӮ
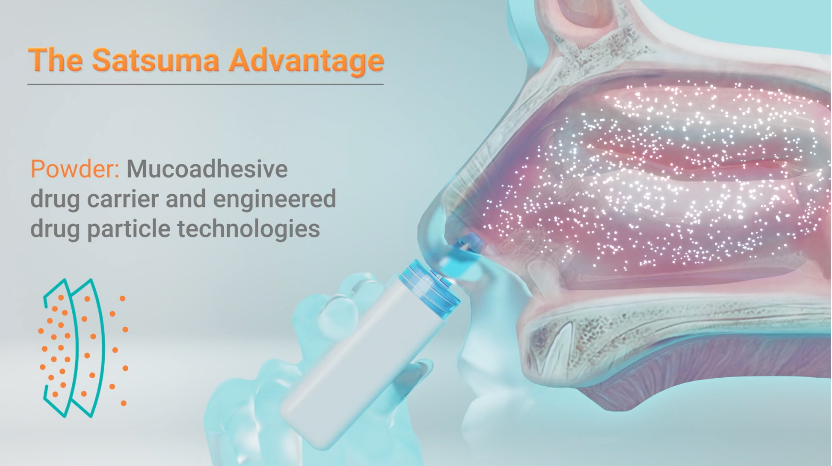
DHE жҺЁиҚҗдҪңдёәжҖҘжҖ§еҒҸеӨҙз—ӣзҡ„дёҖзәҝжІ»з–—пјҢе·ІиҺ·жү№зҡ„еүӮеһӢеҢ…жӢ¬жіЁе°„еүӮе’Ңж¶ІдҪ“йј»е–·йӣҫеүӮгҖӮ
Satsuma з§°дёҺж¶ІдҪ“йј»е–·йӣҫеүӮеҲ¶еүӮзӣёжҜ”пјҢSTS101 зҡ„еҗёж”¶йҖҹеәҰжӣҙеҝ«пјҢ并且жӣҙеҝ«ең°иҫҫеҲ°еі°еҖј DHE иЎҖжөҶж°ҙе№іпјҢиҪ¬еҢ–дёәжӣҙеҘҪзҡ„з–—ж•ҲгҖӮ
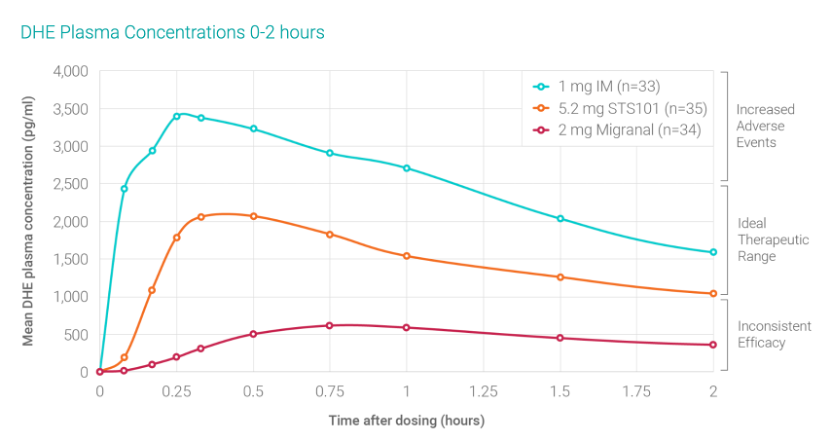
Satsuma зҡ„дёҠеёӮз”іиҜ·жҳҜеҹәдәҺдёҙеәҠ III жңҹиҜ•йӘҢ ASCEND з ”з©¶е’Ң SUMMIT з ”з©¶гҖӮ
еңЁ ASCEND з ”з©¶дёӯпјҢ18 дёӘжңҲеҶ…еҗ‘ 446 еҗҚе…Ҙз»„жӮЈиҖ…жҸҗдҫӣдәҶи¶…иҝҮ 10,500 еүӮ STS101гҖӮеңЁжІ»з–—еҗҺдёӨе°Ҹж—¶ STS101 еҸҜд»ҘдҪҝжүҖжңүжҺҘеҸ—жІ»з–—зҡ„еҒҸеӨҙз—ӣеҸ‘дҪңдёӯ 34.2% зҡ„жӮЈиҖ…ж‘Ҷи„ұз–јз—ӣпјҢ53.4% жӮЈиҖ…ж‘Ҷи„ұжңҖд»ӨдәәдёҚйҖӮзҡ„з—ҮзҠ¶пјҢиҝҳж¶ҲйҷӨдәҶ 94% зҡ„жІ»з–—еҸ‘дҪңдёӯеҜ№зј“и§ЈиҚҜзү©зҡ„йңҖжұӮгҖӮ
дҪҶ SUMMIT з ”з©¶жңӘиҫҫеҲ°дё»иҰҒз–—ж•Ҳз»ҲзӮ№пјҢSTS101 еңЁжІ»з–—еҗҺдёӨе°Ҹж—¶ж— з–јз—ӣе’ҢжңҖд»ӨдәәзғҰжҒјзҡ„з—ҮзҠ¶ж–№йқўдёҺе®үж…°еүӮжІЎжңүжҳҫи‘—еҢәеҲ«гҖӮ
еңЁе®үе…ЁжҖ§ж–№йқўпјҢSTS101 жІЎжңүеҸ‘зҺ°дёҘйҮҚдёҚиүҜдәӢ件пјҢеӨ§еӨҡж•°жҜ’жҖ§жҳҜиҪ»еҫ®дё”зҹӯжҡӮзҡ„гҖӮ
ж—Ҙжң¬зҡ„еҲ¶иҚҜе·Ҙдёҡж°ҙе№ій«ҳпјҢзү№еҲ«жҳҜеңЁеҢ–иҚҜдёҠз§ҜзҙҜж·ұеҺҡпјҢеҚідҫҝеҰӮжӯӨд»Қ然йқўдёҙ CMC зҡ„жҢ‘жҲҳгҖӮ
жҲ‘еӣҪе’Ңж—Ҙжң¬еҲ¶иҚҜиЎҢдёҡйғҪжҳҜд»Һд»ҝеҲ¶иҚҜиө·е®¶гҖӮд»ҝеҲ¶иҚҜдёҠжңүйҖ иҜЈзҡ„е…¬еҸёеӨ§еӨҡйҖүжӢ©е…Ҳд»ҺеҲӣж–°еүӮеһӢеҲҮе…ҘеҒҡеҲӣж–°иҚҜпјҢжҢүзҗҶиҜҙ CMC еә”иҜҘжҳҜжңҖж”ҫеҝғзҡ„дёҖеқ—пјҢз»“жһңВ Satsuma жҒ°жҒ°жҠҳеңЁиҝҷйҮҢгҖӮ
жңүжІЎжңү CMC еӨ§дҪ¬и®Іи®ІеҸҜиғҪжҳҜе“Әж–№йқўгҖҒе“ӘдёӘзҺҜиҠӮеҮәзҡ„й—®йўҳпјҹжҢүзҗҶиҜҙ CMC й—®йўҳеңЁз”іжҠҘд№ӢеүҚзӣ‘з®Ўжңәжһ„е°ұдјҡжІҹйҖҡгҖӮдёәд»Җд№ҲиҝҷдёӘжЎҲдҫӢдёӯеҲ°дәҶдёҠеёӮз”іиҜ·йҳ¶ж®өжүҚиў«зӣ‘з®Ўжңәжһ„жҢҮеҮәжқҘпјҹ
еҠ иҖҒй»„еҫ®дҝЎпјҢжӢ“е®ҪдҪ зҡ„еҲӣж–°иҚҜдәәи„үеңҲпјҡ
е’ҢиҖҒй»„жҲҗдёәжңӢеҸӢеҗ§

еүҚжІҝз”ҹзү©жҠҖжңҜиҝӣеұ•
еҢ»иҚҜиЎҢдёҡеҗҲдҪңдәӨжөҒ


