丙烯酰化反应
直接合成法
丙烯酰氯直接和胺反应。
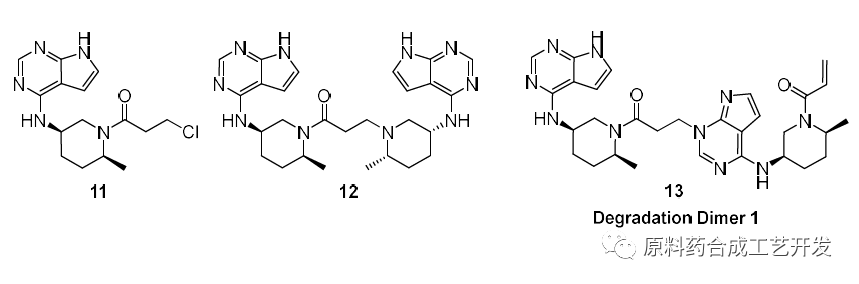
缺点1,典型杂质谱,迈克尔加成导致的二聚杂质 缺点2,当底物亲核性不好时,丙烯酰氯的活性不如3-氯丙酰氯,反应可能不好
3-氯丙酰氯先和胺反应,再消除氯,获得双键。 缺点1,两步反应 缺点2,消除时,针对杂质水平,选择碱
最初选择丙烯酰氯直接进行酰化,杂质11和杂质12以及杂质13均难控制。
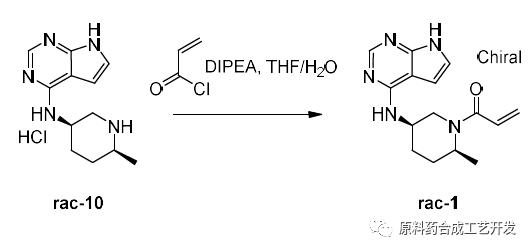
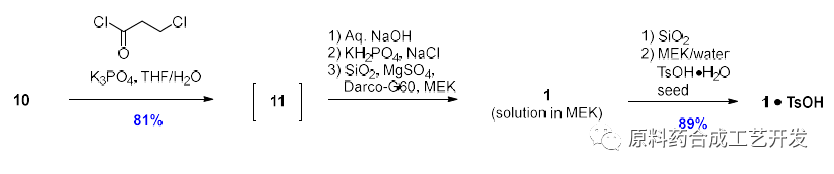
采用氯丙酰氯和化合物10反应,先得到化合物11。
然后碱性消除得到化合物1的溶液,最后二氧化硅处理,TsOH成盐得到API。解决了丙烯酰氯条件得到API不稳定的问题。
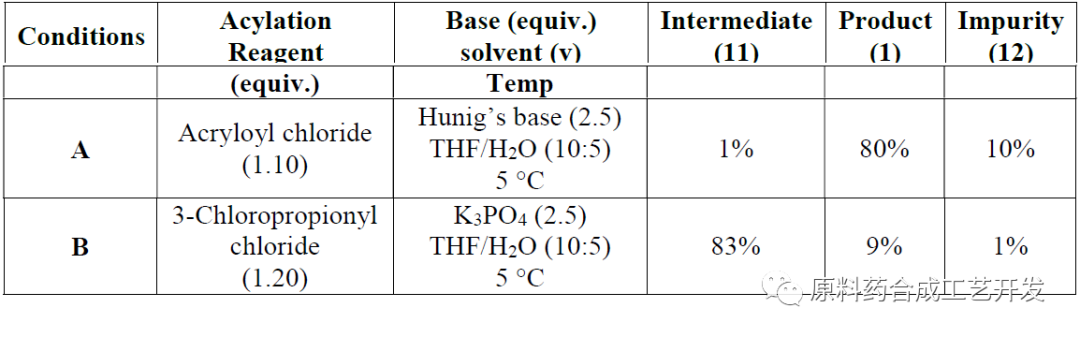
条件对比,多走一步,解决难度
案例:Futibatinib
文献10.1021/acs.oprd.1c00145
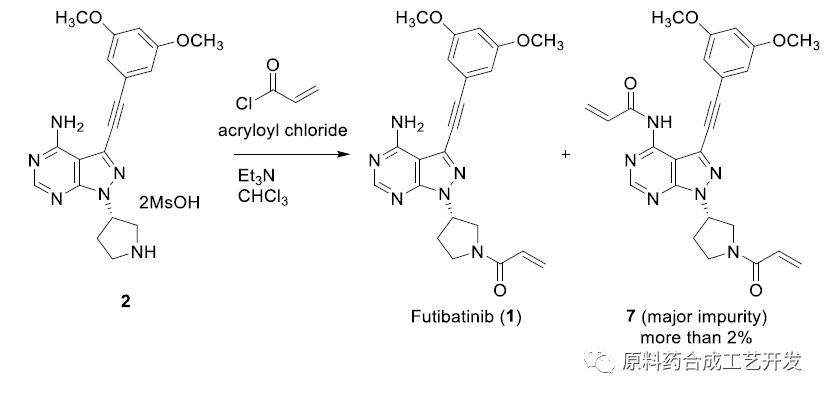
最初路线,化合物2在碱性条件下和丙烯酰氯直接反应,虽然能得到合格的API,但是酰化反应速度快,双酰化杂质7很难控制,纯化需要柱层析。
为了避免杂质7的风险,改变思路,采用3-氯丙酰氯,酰化后原位消去制备丙烯酰化基团。
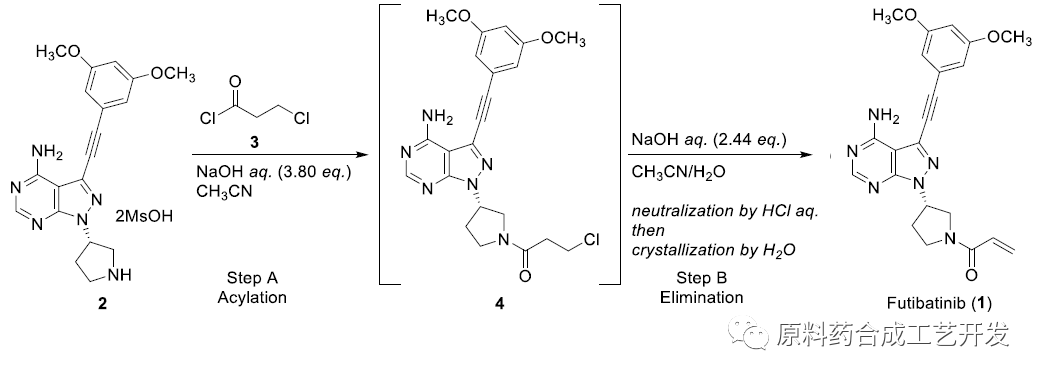
化合物2在乙腈和氢氧化钠水溶液两相中,和3-氯丙酰氯进行酰基化(step A)
一锅法在氢氧化钠水溶液和乙腈体系中进行氯的消去反应,酸化后,加水析出API(step B)
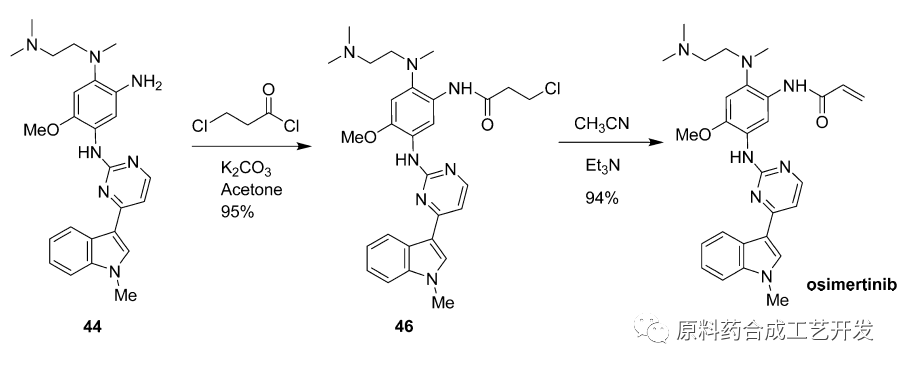
案例:奥希替尼
文献Org. Process Res. Dev. 2016, 20, 2028−2042
最初采用,化合物44直接和丙烯酰氯反应,制备API,杂质多,纯化困难,收率低
改进后采用,化合物4先和3-氯丙酰氯反应,得到化合物46,再脱去卤素获得双键,得到API。
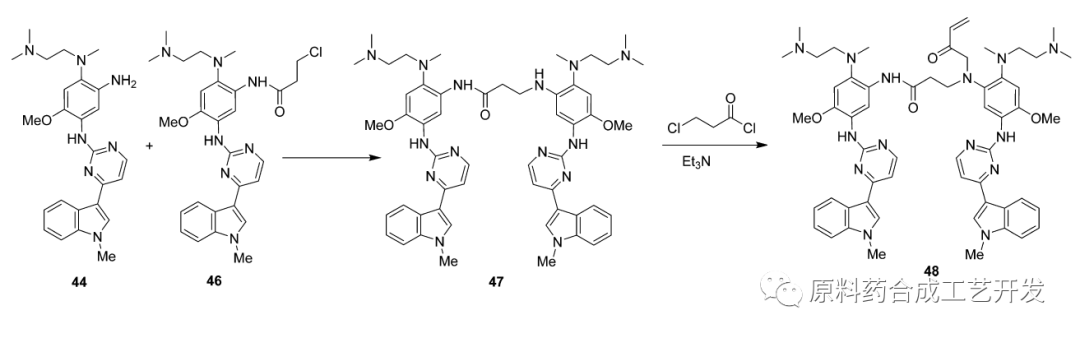
即使采用3-氯丙酰氯,也会有二聚杂质产生,路径如下
案例:mobocertinib
原研专利CN112313223
合成路线的最后两步:第五步和第六步
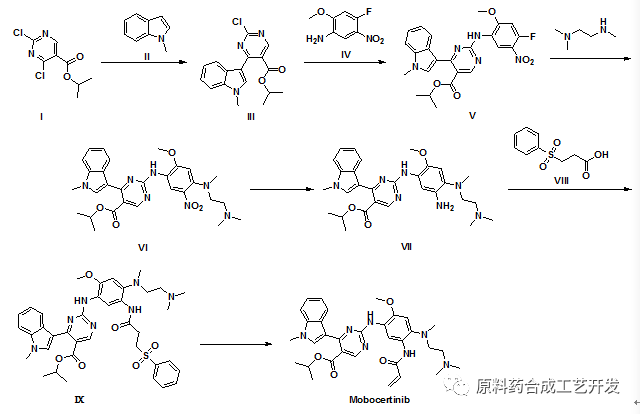
第五步:化合物VII和化合物VIII经T3P的酸胺缩合反应,得到化合物IX;
第六步:三甲基硅醇钾作用下,发生消除反应得到API。


