基于中空纤维的膜过滤已成为灌流工艺中细胞截留的主导技术,但减轻过滤器污染的重大挑战仍未解决。在这项工作中,通过压力表征实验和灌流细胞培养运行,研究了将并流滤液流应用于切向流过滤(TFF)组件、以减少甚至完全消除组件内轴向压降引起的Starling再循环的好处。此外,还研究了在单向 TFF 内实现交替 Starling 流的新颖概念。压力分布表明,实验室规模和生产规模的过滤器都可以实现精确的流量控制。与标准 TFF 相比,并流 TFF 系统的产品筛分率提高了 40%。并流 TFF 中跨膜压力与错流速度和过滤器特性的解耦缓解了基于中空纤维的系统的常见挑战,例如有限的错流速率和相对较短的过滤器组件长度,这两者目前都用于避免沿过滤组件的压力降。因此,单向 TFF 系统中的并流滤液流动代表了标准 TFF 或交替 TFF 操作的有趣且可放大的替代方案,并具有控制 Starling 再循环流动的额外可能性。
基于中空纤维的切向流过滤已成为哺乳动物灌流工艺中最优选的细胞截留技术之一,应用于主要阶段的灌流生物反应器以及改进现有补料分批生产装置的 N-1 生物反应器中。尽管泵技术取得了显著进步,例如低剪切隔膜泵或悬浮离心泵,但仍需改进培养活性,从而减少过滤膜上引起污染的颗粒的负载,过滤器堵塞和产品截留仍然是稳健生产工艺的主要挑战。
单向错流模式的切向流过滤 (TFF)(通常由悬浮离心泵驱动)和交替切向流(ATF,由隔膜泵驱动)是灌流工艺中最常报道的系统。大多数研究表明,在实验室规模下,ATF 表现出优于 TFF 的产品筛分效果,并表明 ATF 是一种更适合长期灌流操作的技术。然而,隔膜泵驱动的 ATF 系统与生产规模的运行不稳定有关。此外,需要多个并行 ATF 系统来运行 2000 L 灌流生物反应器,与类似的 TFF 系统相比,需要更多的占地面积。因此,TFF 系统由于更小的设施占地面积和更高的稳健性而被认为是大规模行业内的首选,而 ATF 系统则显示出改进的产品筛分并缩短了中试规模操作的开发时间。
在 TFF 中,浓差极化和污染都会影响产品截留。与运行时间短、滤液通量高的工业 TFF 应用相比,在灌流工艺中用作细胞截留装置的 TFF 系统的运行时间必须为长达数月(无需清洁),并且在相对非常低的滤液通量(约 2 L/m2/h)下运行。由于低滤液通量和高轴向压降,滤液在过滤器出口处会逆流回到纤维管腔中。这种所谓的 Starling 再循环(Starling,1896)经过建模并显示出明显大于典型灌流工艺中的实际收获率。因此,实际中空纤维膜表面积仅略多于 50% 用于过滤。
最近,交替 TFF 系统被描述为使用一个悬浮离心泵和阀门来切换错流方向,或者在回流回路中使用两个交替、反向定位的离心泵,称为反向 TFF (rTFF)。与单向 TFF 系统相比,两种设置均显示出产品截留率降低。虽然交替错流过滤(ATF、rTFF 或通过阀门切换实现交替错流)的每个单独阶段都可以与 TFF 系统中的情况进行比较,但区别因素在于错流的交替方向,因此也取决于过滤器入口位置的变化。当处理易于聚集的细胞系时,切换过滤器入口可以防止纤维阻塞。与 TFF 相比,交替错流系统的产品筛分效果得到改善,进一步归因于各相之间的短时间净流量为零,导致整个过滤器长度上的 TMP 非常低,可能导致沉积层松弛。还有人提出,在中空纤维两端之间切换的 Starling 再循环可以去除沉积材料,从而最大限度地减少污染。此外,交替错流过滤利用整个过滤器长度,利用组件的整个膜表面。交替 TFF 性能的提高可能是这些因素综合作用的结果。
尽管交替错流过滤有几个优点,但值得注意的是,过滤器出口处的滤液反冲必须通过过滤器入口附近增加的滤液通量来平衡,以保持相同的总体过滤水平。这会导致将颗粒推入膜的阻力增加,从而导致更密集的沉积物和更大的颗粒渗透到膜中,这两者都可以通过不可逆污染阻力的增加来检测。研究证明,ATF 系统中最大的污垢发生在中空纤维组件的末端,即滤液通量最大的地方。这可能解释了尽管使用适当尺寸的 ATF 组件,但仍观察到产品显著筛分损失的研究。
这些现象为中空纤维设计和确定灌流系统的最佳操作条件提供了显著的限制。例如,错流速度必须保持较低,以减少沿过滤器长度的压降,从而减少 Starling 再循环。然而,减少错流会增加细胞在再循环回路内的停留时间,从而存在氧气耗尽的风险。此外,低错流会导致更大的浓差极化,即细胞在膜表面更多的积累。随着中空纤维组件长度的增加,轴向压降增加,对此,可使用相对较短的过滤组件,但需要多个过滤器并联以满足更大过滤面积的需要。增加中空纤维的内径也会减少沿纤维长度的压降,但代价是组件内的滞留体积更大。
尽管所有这些提高过滤性能的策略都试图减少压降和 Starling 流的影响,但它们都没有解决局部 TMP 与错流大小(决定轴向压降)和过滤器特性。为了在整个组件中实现几乎均匀的 TMP,必须在组件的滤液侧产生与回流侧类似的压降。这个生物制药行业的概念最初被称为高性能 TFF (HPTFF),并被成功证明可以控制沿过滤器长度的浓差极化,从而在下游操作中实现高分辨率蛋白质-蛋白质分离。它还使用超滤改进了病毒载体的纯化。这一概念在乳制品行业的微滤中更为人所知。独立于过滤组件的错流和长度来控制滤液通量和 Starling 流的能力为克服当前 TFF 和 ATF 系统在灌流工艺中的挑战提供了一个有前景的工具。据作者所知,文献中尚未评估 HPTFF 减轻灌流工艺中产品滞留的作用。
本研究的目的是开发一种用于灌流工艺的并流过滤系统,该系统基于一次性低剪切离心泵并结合压力传感器,最终目标是减少产品滞留。这种所谓的 HPTFF 系统通过沿过滤器组件长度测量 TMP 来表征各种操作条件。与标准 TFF 相比,HPTFF 期间的稳态灌流细胞培养运行表现出优越的性能。此外,还引入了步进并流 TFF (scTFF) 的新概念,使我们能够在单向 TFF 系统内生成交替的 Starling 再循环。随后,通过记录沿改进的大型中空纤维组件的压力分布,成功评估了 HPTFF 和 scTFF 的可放大性。
详细的试验操作和结果,请参考原文。
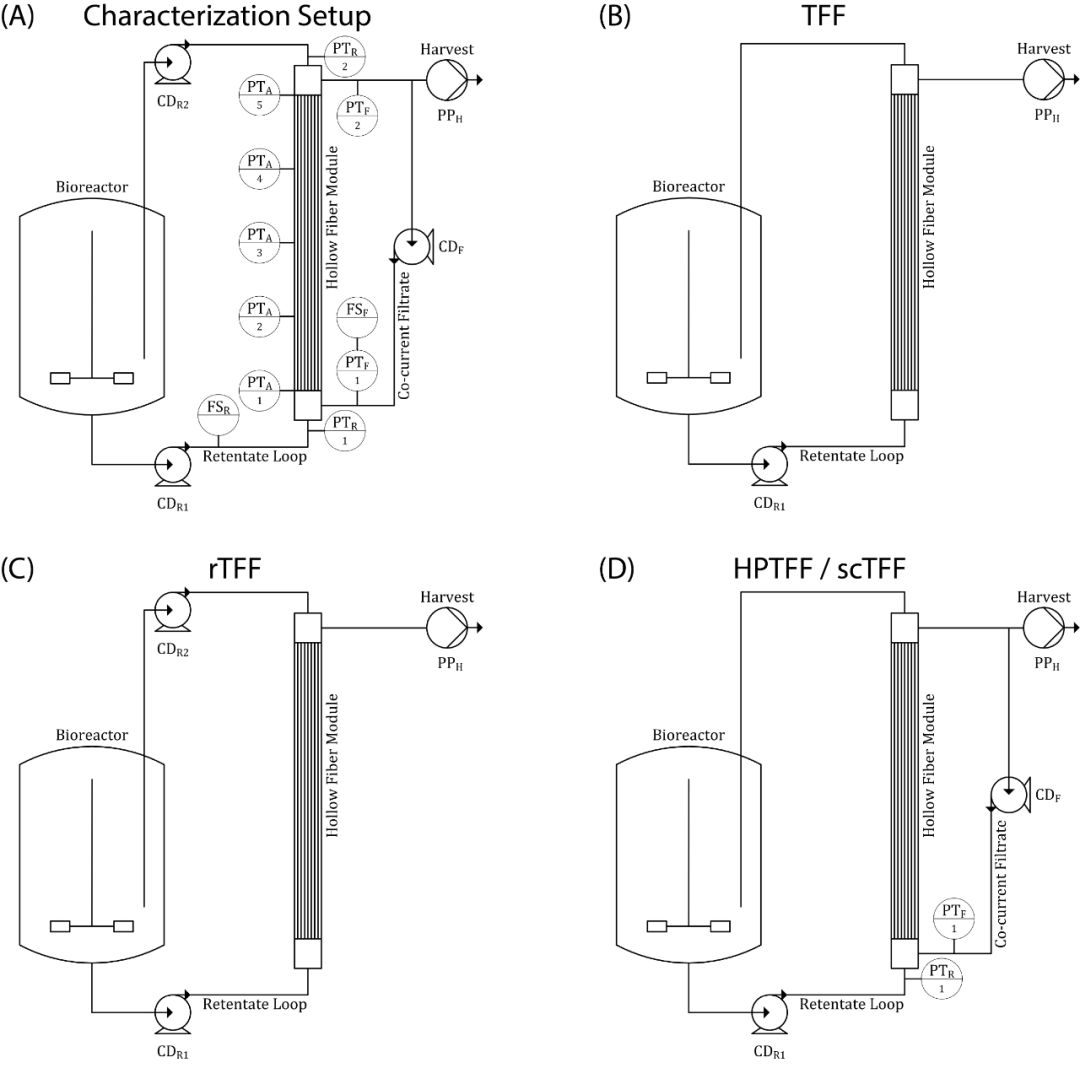
图 1 用水进行的压力表征实验装置的详细示意图 (A):压力变送器 (PT)、流量传感器 (FS)、离心泵 (CD) 和蠕动泵 (PP),根据其位置用下标字母表示(R:回流液;F:滤液;A:滤液侧附加传感器;H :收获)。进一步显示了用于细胞培养运行的 TFF (B)、rTFF (C) 和 HPTFF 或 scTFF (D) 操作所需的最低设置。
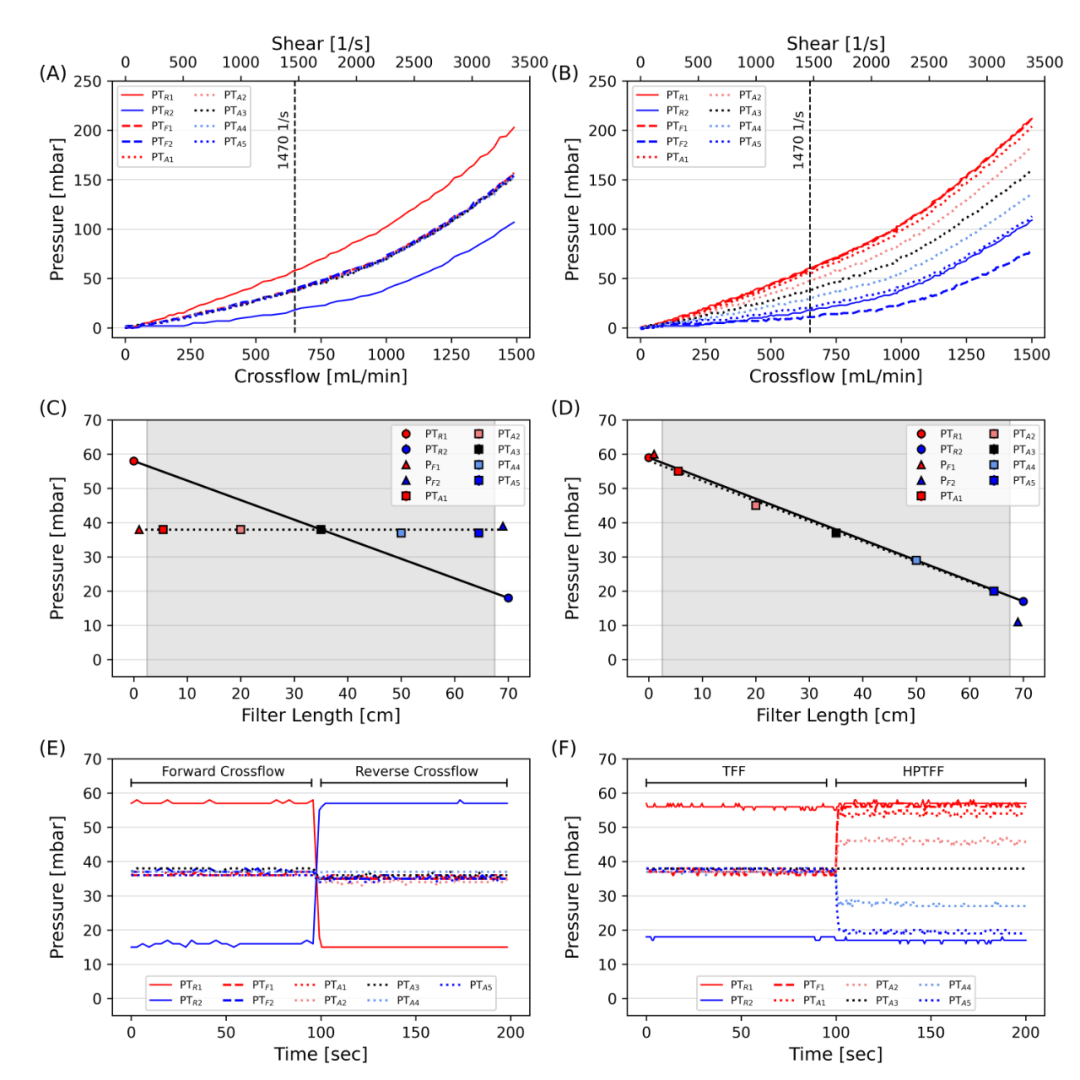
图 2 TFF、rTFF 和 HPTFF 操作的压力表征结果。 TFF 和 rTFF 操作中的错流变化 (A) 以及 HPTFF 操作中带增量压力控制的错流变化 (B)。虚线代表 1470 s-1 剪切力的标准操作区域,产生约 650 mL/min 的错流。为 TFF 和 rTFF (C) 的前向错流阶段提供了根据其沿过滤器长度的位置的压力测量值,而对于 HPTFF (D),灰色区域代表绝对纤维长度。显示了 TFF 和 rTFF (E) 在 650 mL/min 错流下的压力分布与时间的关系,其中正向错流阶段对应于 TFF 操作,而 rTFF 是通过正向和反向错流之间的交替来定义的。在 650 mL/min 错流 (F) 下进一步测量并流滤液流启动时 HPTFF 压力分布与时间的关系。
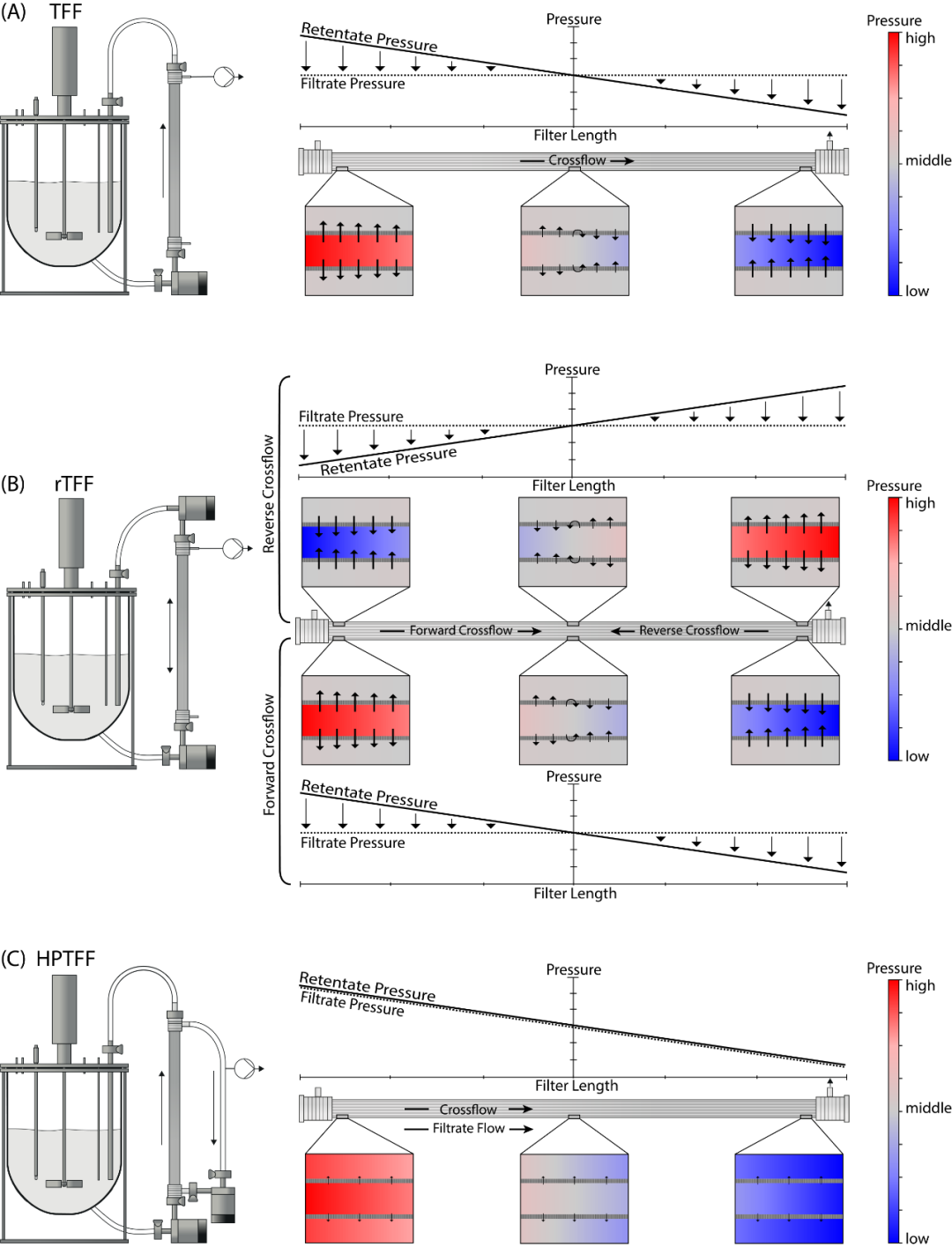
图 3 基于压力表征的带有离心泵的 TFF (A)、rTFF (B) 和 HPTFF (C) 系统示意图。给出了每个系统沿过滤器长度的压力曲线,箭头表示滤液通量,较长的箭头表示较大的通量。此外,还提供了过滤器开头、中间和末端的纤维放大图,并从红色(高压)到蓝色(低压)着色。由于rTFF由两相组成,因此描述了正向错流和反向错流的情况。
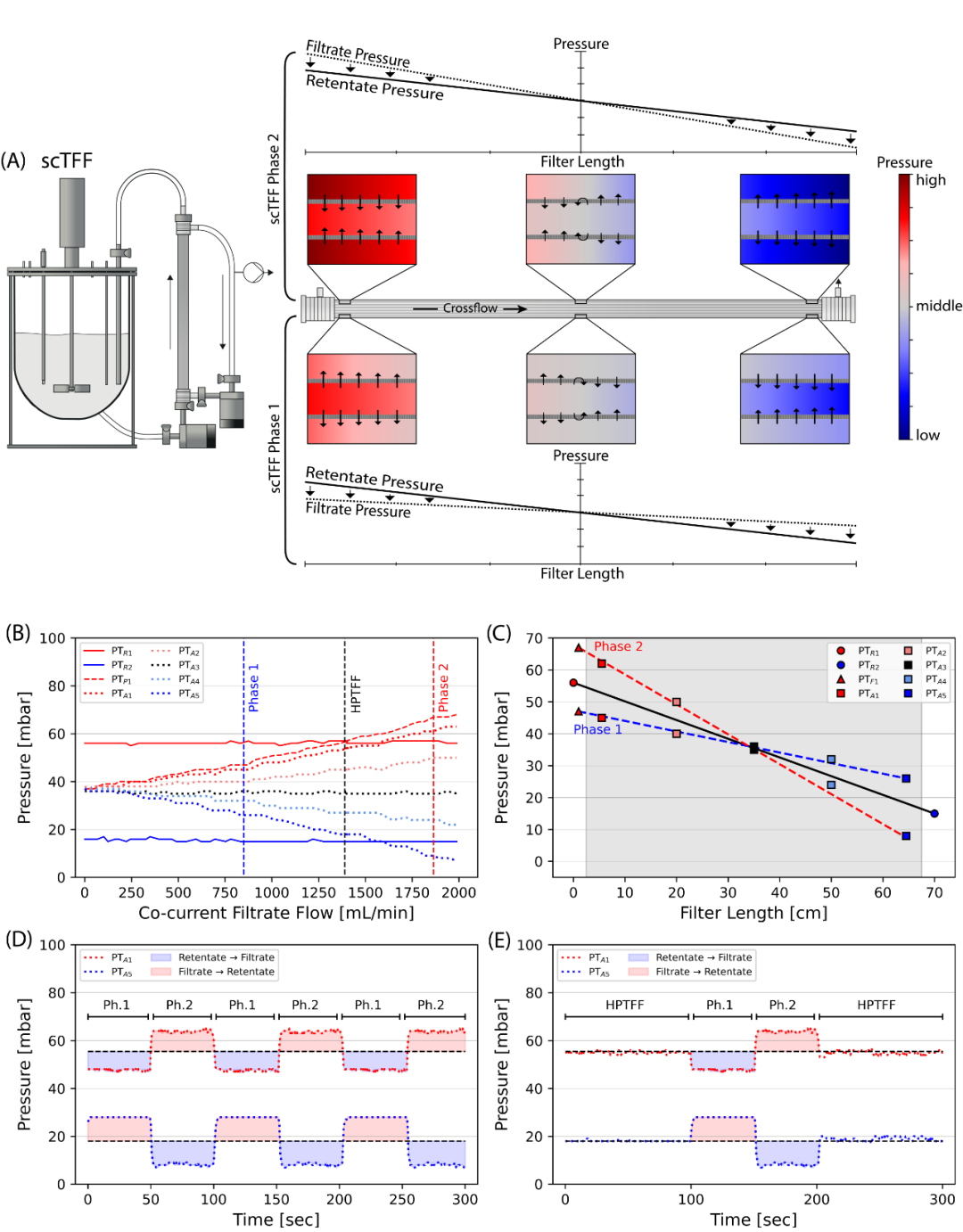
图 4 通过沿过滤器长度 (A) 的压力梯度的示意图表示步进并流 TFF (scTFF) 的概念。以 650 mL/min 错流 (B) 的并流流量增加。垂直虚线代表过滤器入口处 HPTFF(黑色)、具有 -10 mbar 压差(蓝色)的 scTFF 第 1 相和具有 +10 mbar 压差(红色)的 scTFF 第 2 相的操作条件。为所有三条虚线 (C) 提供根据其沿过滤器长度的位置的压力测量值,灰色区域代表绝对纤维长度。时间分辨压力分布图 (D) 演示了 scTFF 具有两个交替相(±10 mbar 压力差)的操作。 HPTFF 的替代操作模式,在 HPTFF 相之间通过 ± 10 mbar 的 scPTFF 相交替进行膜扫描 (E)。红色区域代表滤液返回回流的通量,蓝色区域代表从回流到滤液的通量。
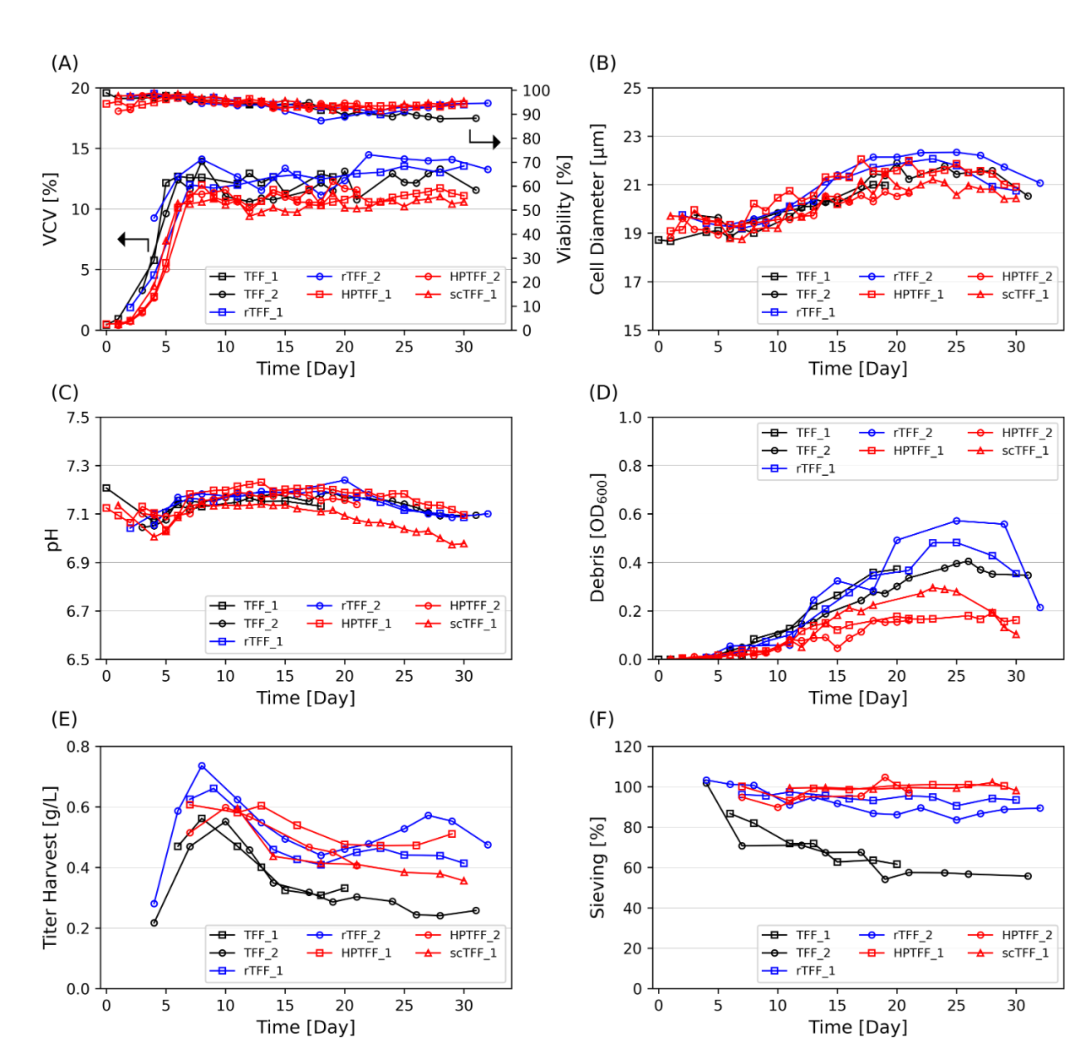
图 5 使用 TFF(黑色)、rTTF(蓝色)、HPTFF 或 scTFF(红色)作为细胞截留装置进行灌流细胞培养。 VCV 和活力 (A)、细胞直径 (B)、pH (C)、细胞培养碎片 (D)、收获滴度 (E) 和产物筛分 (F)。
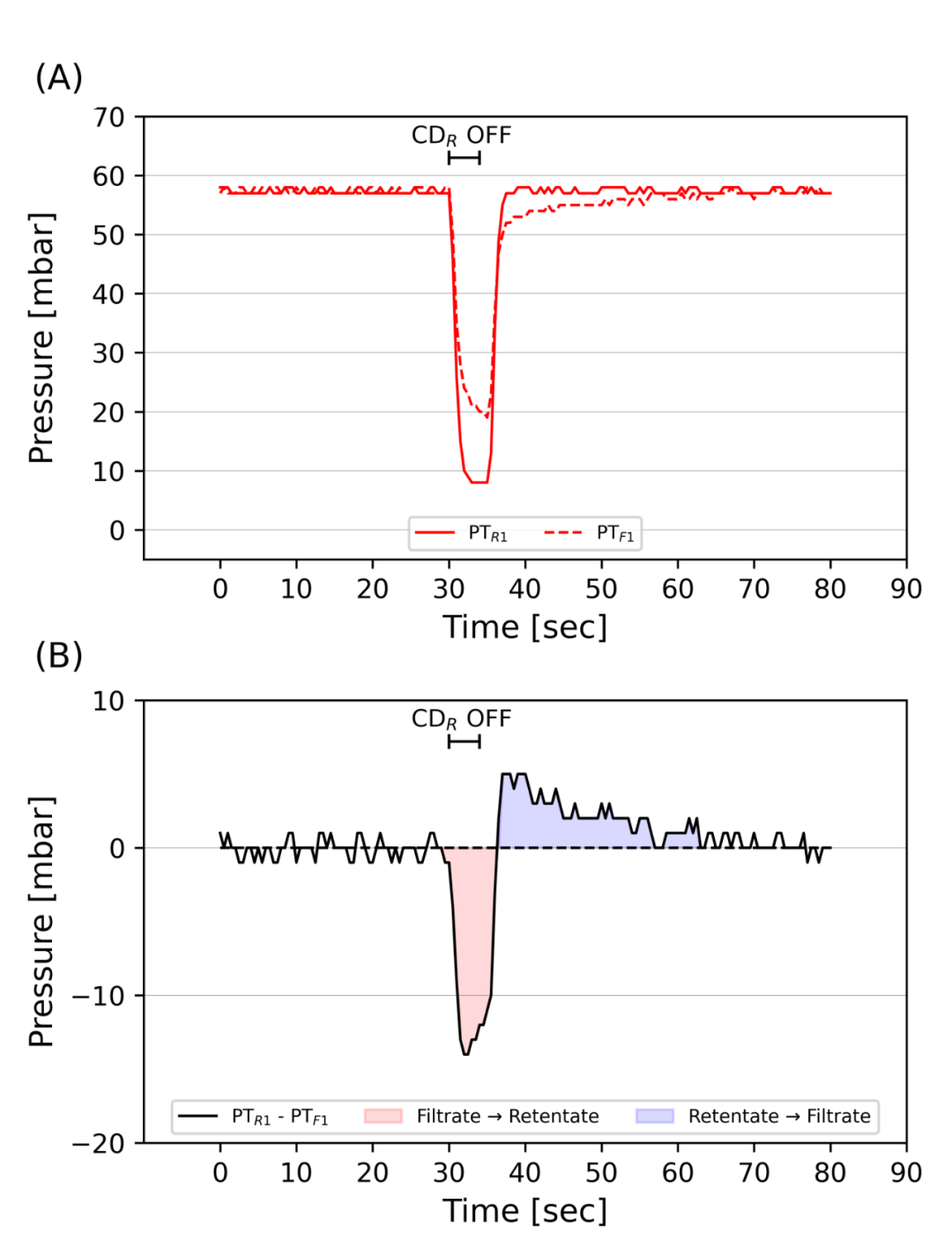
图6. HPTFF操作中错流停止时的膜冲扫。在悬浮离心泵停止3秒以释放气泡时记录回流的入口压力和滤液侧的入口压力(A)。计算了增量压力,蓝色区域代表负增量压力,在此期间过滤器的前半部分发生反冲,而红色区域代表正增量压力,导致过滤器的后半部分发生反冲(B )。
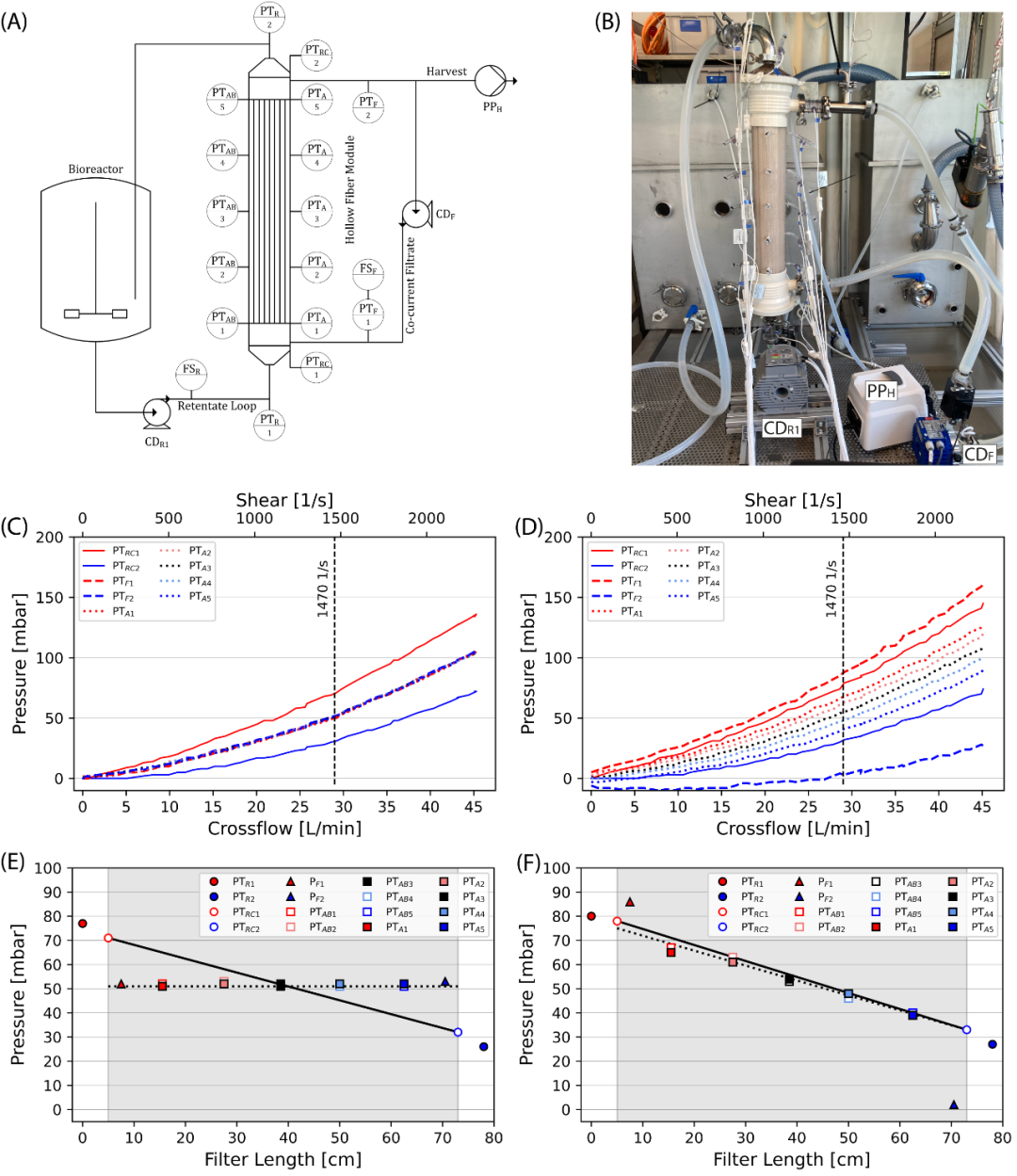
图 7 大规模压力表征结果。水中大规模压力表征的实验装置示意图 (A) 压力变送器 (PT)、流量传感器 (FS)、离心泵 (CD) 和蠕动泵 (PP) 根据其位置用下标字母表示(R:回流液;F:滤液;A 和 AB:滤液侧附加传感器;H:收获)。实验装置图片 (B)。 TFF 操作中的大规模错流变化 (C) 和 HPTFF 操作中的具有增量压力控制的错流变化 (D)。在 1470 s-1 剪切力的标准操作下,为 TFF (E) 和 HPTFF (F) 提供了根据其沿过滤器长度的位置的压力测量值,灰色区域代表绝对纤维长度。
本研究使用中空纤维组件作为细胞截留装置,评估了稳态灌流工艺中并流滤液流对产品截留的影响。 TFF 和交替错流 TFF 中的 Starling 再循环取决于错流速度和过滤器组件特性,而并流滤液流量可以独立控制 Starling 再循环。通过沿过滤器组件长度插入额外的压力传感器进行压力表征研究,揭示了对滤液压力梯度的详细了解,并证实了通过并流滤液流改变 TMP 的理论概念。此外,Starling 流量的控制不仅在实验室规模上得到验证,而且还成功应用于生产规模的过滤组件。 HPTFF 操作或在 scTFF 操作中精确控制 Starling 再循环的方向和强度的优势在稳态灌流细胞培养工艺中得到了进一步证明,与标准 TFF 操作相比,该工艺显示出更高的产品筛分。通过并流滤液流动操作实现的 Starling 流量控制不仅是研究过滤器污染的有效工具,而且还可以减少稳定灌流细胞培养工艺以及动态灌流或 N-1 灌流等其他操作中的产物截留。
原文:P.Romann, P.Giller, A.Sibilia, et al., Co-current filtrate flow in TFF perfusion processes: Decoupling transmembrane pressure from crossflow to improve product sieving. Authorea, 2023.


