有机合成工艺优化-12.产物和杂质
12.4纯度及杂质事项:冷却的最终过程
含量低的杂质也很可能带来问题。在20世纪80年代末至90年代初,EMS综合症的爆发就与一种从色氨酸食物添加剂中发现的低浓度发酵衍生杂质有关。据疾病控制中心的--位研究员报道,“当我们谈到生物活性的致污物时,98.5%的纯度并不意味着非常好,极小量的变化就能带来很大的影响。》[5]结果证明造成这种原因的物质可能是不常见的氨基酸1和2 (图12. 4)236.3]。为了解决这个问题,生产者使用了另外一种微生物通过发酵的方法来生产色氨酸。
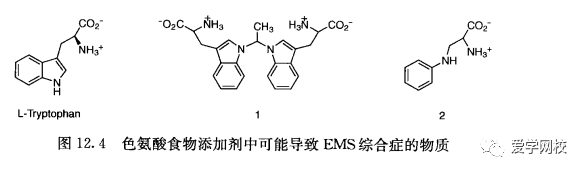
通过气味也可以判断杂质的浓度可能在ppb范围内,但若无法控制这些杂质的浓度而使患者受到不良影响,就可能带来巨大的经济损失。只要找到了造成这种原因的反应试剂,消除这些杂质带来的问题通常是非常容易的。然而,当杂质含量非常低时,确认造成这种原因的试剂可能并不那么容易。
提示:从有机合成的观点来看,反应不理想会导致杂质的产生。甚至低产率的反应也可能产生大量的杂质,还有可能导致产物重新制备及路线重新设计。
这批产品纯度一定要与标准纯度比较,并且要确定每种杂质的结构及含量。根据FDA的规定,药物中每种杂质的含量应在0.1%的水平(或高剂量药物杂质含量应为0. 05%)[39]。当毒理学研究完成,并且原料的毒性可以接受,批处理的杂质毒性合格等,就可判断处于安全水平。
为了避免将来重复生产,重要的是建立合理的常规质量标准及用于毒性筛选的候选药物的杂质含量标准。需要合成一批用来建立常规质量标准的原料药。利用结晶可适当提高质量,但没有必要制得超高纯度的原料药,除非这种高质量原料药能通过常规方法制备。通过色谱或固相合成来小规模制备高纯度原料是不合理的,除非这些方法适用于原料药物的常规生产;否则,其杂质结构和杂质含量可能与通过常规重结晶或液相合成纯化所得的产品不同。前几年,对物理性质及杂质结构改变的机会受限于药物的发展,所以在早期的候选药物研究中应该进行彻底的分析研究,并且应贯穿于临床及批量的生产。
为了确定杂质结构和浓度水平,应该优化原料药的最终分离工艺,并据此制备用于毒理研究和以后I期临床研究的原料药。原料药中的杂质种类主要取决于制备原料药最后-步使用的原料和试剂。因此,早期研究中应确定好倒数第二个化合物,并把平行研究工作集中在此化合物上。为了节省研究的时间和费用,重要的是提“早冻结最终过程”,也就是说,提早确定最终的化学变化,从而制得原料药[40]。但是,在制备潜在的候选药物用于I期临床研究时,可能最难研究的是如何实现理想的最后一步及纯化,同时能定期制备原料药。
即使还不知道杂质的性质,也通常采用重复操作来提高终产物和关键中间体的质量。制备产物采用最初的重结晶和分离条件,就不可能有效除掉主要杂质。要凭借化学知识和经验来研究重复操作。
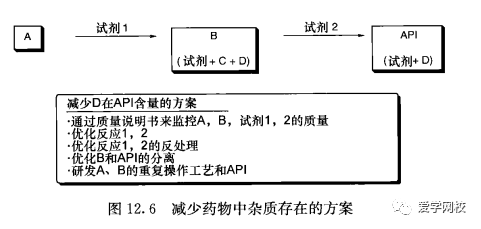
一旦杂质的结构确定了,研究尽量减少药物中主要杂质的方法就简单了。两种基本的选择可以利用:其一,尽量减少杂质的形成;其二,尽量减少药物中杂质的存在。可能需要对所有中间体和试剂进行分析。通过制定中间体和试剂中能接受的杂质含量说明书,纯化终产物的工作就能简化或消除。减少药物中杂质存在的一般方案见图12. 6。
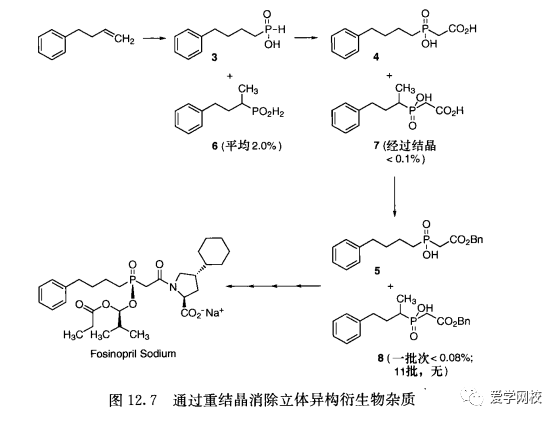
利用此方法合成的例子如图12. 7。在磷诺普利钠盐的中间体3合成中,化合物3含有2%的立体异构杂质[41]。而化合物3和6的化学性质非常相似,所以难以将它们分离开,希望能通过以后中间体衍生物的纯化来除掉杂质,从而得到纯化的终产物。既然化合物3为低熔点固体,可作为固体残渣分离出来,则无需通过重结晶来纯化得到(化合物3的纯化受二环己基胺盐重结晶的影响,但是制备和分离此盐需要对另外两步进行研究)。
化合物3向化合物4转化过程中,化合物7也被检测到;而化合物4的重结晶过程将化合物7的浓度降低到小于0.1%。随后化合物5的制备和纯化有效清除了立体异构体8(11批中仅有一批中检测到化合物8)。从化合物5来合成磷诺普利钠盐有4次重结晶,因此在含有衍生立体异构杂质的磷诺普利钠盐中其污染物浓度将远低于0.1%。
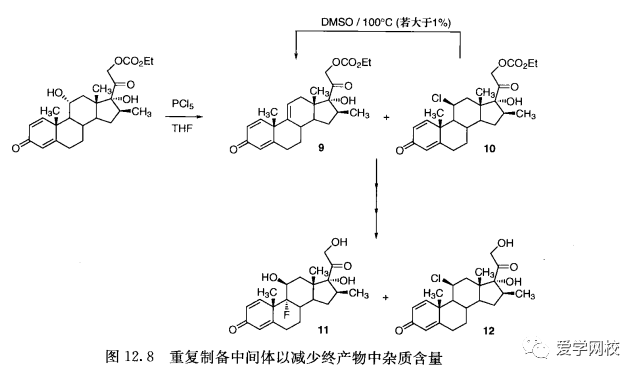
如果杂质的形成和存在不能清除,就要通过实验来证明不同浓度的杂质和杂质前体是否对最后一步或整个过程有 影响。设计最佳路线来合成倍他米松11,产率提高到30%,并且11的纯度提高到99%以上(图12. 8)[40]。第一步中形成的绿色副产物10
转化成相应的倍他米松杂质12。后一个杂质是新的,在通过PCIs 这条路线合成11 的批次中浓度接近0. 1%。毒理学研究显示并非有利的选择。发现在倍他米松的处理过程中允许9中有高达1%的10存在;如果10的浓度远大于1%,在100C、DMSO作溶剂的条件下,残留的10会转化为9。先前的重复操作可以使有杂质分布图的倍他米松的制备与最初的路线所制备的相媲美或者更好。
提示:通过控制倒数第二个中间体中的杂质来控制原料药物中的杂质。
有色杂质对原料药会造成很大影响。低浓度杂质能带来强的颜色,但想确认并清除造成这种原因的试剂可能非常困难[16]。一般金属盐或高不饱和度的化合物能形成有色杂质。通过原子吸收或其他方法来分析原料药,确认其是否含有金属致污物。如果金属络合物不会产生有色物,证明有色杂质可通过活性炭或固相(固相吸附剂,SPE[42]吸附并洗涤除掉。
为避免产生未知的有色杂质,进行实验研究是有必要的。例如,通过把反应温度控制到较低,可减少有色产物的形成。
总结:


