
课程推荐:
2023细胞治疗产品注册临床与IIT研究新政策落地介绍及全流程解析专题
2023.9.6-8药品质量可控性原理指导下的分析方法验证和质量标准制定策略专题培训班
线上课9.23-24生物冻干制剂开发:处方研究与工艺流程专题互动问答指导高级研讨班
【千人盛会】9月21日—23日青岛市“第七届生物活性肽健康产业论坛暨第二届千滋百[肽]优肽盛典”
【线上开课啦】2023特医食品研发注册风险规避与技术审评重点关注问题、原料筛选及特定全营养配方设计指导--9月2-3日
【南京】9.21-23GMP检查法规全梳理及迎检准备实战攻略
线上课2023.9.23-24研发质量体系构建中关键要素及研发QA能力提升
【延期至9.9-10】 CHO细胞培养过程质量调控专题培训班
导读:在对国内外关于药品工艺验证有关法规指南分析的基础上,明确了工艺验证的基本原则与要求。通过对近几年国内外药品检查中发现的药品生产企业在工艺验证方面存在缺陷的分析,对工艺验证中的常见问题进行总结、分类与提炼。为我国制药行业进一步做好工艺验证提供参考,同时也为工艺验证的检查提供借鉴。
工艺验证是通过对药品全生命周期中数据的收集与分析,以文件化的科学证据证明工艺能够持续稳定的生产出质量一致的药品,保证其持续符合预定用途和注册标准[1] 。从工艺验证生命周期角度分析,通常包括工艺设计 ( Process design) 、工艺验证( Process qualification) 、持续工艺确认 ( Continued process verification) 与再验证( Re-validation) 几个阶段。目前,随着药品审评审批制度改革的不断深化,法规进一步强化了药品工艺验证的重要性。新修订的《药品注册管理办法》要求申请人完成商业规模生产工艺验证后才可提出药品上市许可申请。科学有效的工艺验证对保证药品质量至关重要。近年来开展的各类药品检查中发现工艺验证仍存在一些待完善的地方[2,3] ,对其进行针对性的分析研究有助于行业不断完善工艺验证,进而更好地保证药品质量。
第一部分 药品工艺验证基本要求概述
验证与确认工作是制药企业质量管理体系的重要组成部分之一。验证是证明任何操作规程或方法、生产工艺或系统能达到预期结果的一系列活动,适用于生产工艺、分析方法、清洁方法以及计算机化系统。工艺验证属于验证的一种,其需要遵循验证的基本要求,重点强调质量风险管理在其中的运用。工艺验证在全球各国或国际组织颁发的药品生产质量管理规范( 简称 GMP) 中均有明确的要求。如 WHO GMP 通则的第 4 节,WHO 确认与验证良好操作规范正文及附件 7,PIC/S GMP 基本原则的第 12 章,欧盟 GMP 基本要求的第 5 章及附录15,ICH Q7 的第 12 节,以及我国 2010 版 GMP 第 7章及确认与验证附录。此外,一些监管机构与国际组织还颁布了一些列工艺验证技术指南,如: 美国FDA“工艺验证指南一般原则与规范”[4]欧洲药品管理局“生物技术活性成分工艺验证和监管递交所需数据”[5]美国注射剂协会“工艺验证: 一种基于生命周期的方法”[6] 等。
对于工艺验证,需要生产企业对生产工艺有充分的理解,通过工艺设计识别出对产品质量产生影响的关键工艺参数( Critical Process Parameter,CPP) 与关键质量属性( Critical Quality Attribute,CQA) ,确认CPP 与 CQA 范围的适用性( 包括最差条件与可变空间) ,明确生产工艺。以此为基础,在工艺验证阶段通过商业化生产条件下的人、机、料、法、环、测等影响质量因素整合的情况下,确认工艺设计阶段结论,证明该商业化生产过程符合预期,明确后期持续监测的重点。持续工艺确认阶段通过对商业化生产状态的持续统计分析[7]证明生产工艺始终处于稳定的控制状态,提供持续的工艺保证[8] 。在药品的生产管理过程中,按照变更程序要求进行变更控制,必要时重新进行工艺验证。
第二部分 药品工艺验证缺陷分析
工艺验证在 GMP 中的重要地位决定了其必然会成为全球各类药品检查的主要内容。事实上,在药品检查工作中,药品工艺验证也是发现问题较为集中的部分。就近年来我国药品 GMP 跟踪检查、药品注册生产现场核查及国外药品监管机构( 包括 WHO、EDQM、FDA 等) 对我国境内药品生产企业检查的缺陷进行梳理,其中涉及工艺验证的近 400 条缺陷按照验证开展的各个环节进行分类统计( 包括 2018—2020 年抽取的约 300 家次检查) ,如图 1。
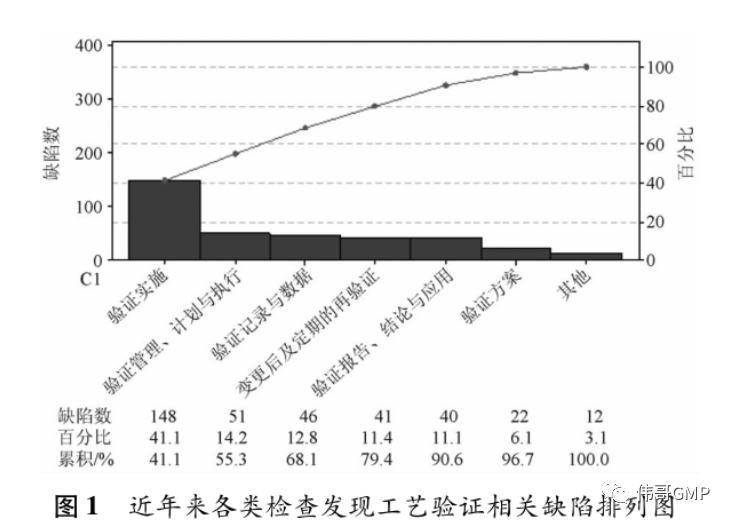
2.1 验证实施
验证实施方面的内容约占工艺验证全部缺陷的 41% ,是问题最为集中的部分,涉及验证内容、验证批量、验证批次数、验证取样策略、验证样品检验、验证偏差处理、验证变更管理等方面的内容。常见问题包括: ( 1) 验证内容未能有效证明生产工艺的稳定性和适用性,涉及未基于风险进行 CPP 及CQA 评估与识别 [9]对部分 CPP 验证不充分、缺少部分 CQA 检测评估、未对 CPP 可变空间进行验证、工艺验证不能代表实际生产情况、未对最差条件( 如除菌过滤最长时间、灭菌前最长存放时间等) 进行验证、工艺验证未包括全部生产工序( 如缺少中药材前处理与提取、原料药粉碎、内包装等) 、取样检测频率过低、取样代表性不足、多台生产设备工艺验证矩阵设计不合理、验证过程中出现的偏差显示工艺稳定性不足等; ( 2) 验证批量与批次方面,存在工艺验证未包括全部生产批量、未进行商业化生产批量的验证、工艺验证连续 3 批均不一致、未针对不同内包装方式分别进行至少 3 批的工艺验证、验证批次数不能证明工艺稳定性等问题; ( 3) 工艺验证样品取样与检测方面,涉及取样计划未基于风险评估且描述不明确( 如取样人员、取样量、取样位置、取样方式等) 、分析检测项目不全( 如缺少粒度、微生物限度等) 、分析方法转移完成时间晚于工艺验证样品检测时间、检测用对照品管理不规范、分析仪器维护不到位、检验人员未按规定方法检测、工艺验证样品有关记录不规范等; ( 4) 工艺验证过程中的偏差及超标与超常结果存在未进行调查处理、调查不彻底、未纳入对应偏差或超标结果台账、未在验证报告中进行分析评估等问题。
2.2 验证管理、计划与执行
工艺验证的管理、计划与执行是验证工作开展的基本框架与总体要求,该部分缺陷位列第 2 位,占比约 14. 2%。常见问题包括: ( 1) 工艺验证管理程序规定不合理或不明确,如未明确工艺验证不可以采用回顾性验证的方式开展、未规定如何基于风险确定关键工艺参数、未明确连续验证三批的要求、直接规定工艺验证批次为 3 批的合理性、未规定验证批次放行上市的条件与要求等; ( 2) 验证计划可操作性差、部分内容缺失,包括未制定验证计划、验证计划未包括工艺再验证、未包括验证完成时间等; ( 3) 工艺验证管理程序中对于如何基于风险开展的验证的规定不合理或缺失,如质量风险评估工具在工艺验证中的应用要求、未基于风险评估来确定再验证的周期等; ( 4)验证执行方面,存在未开展工艺验证、仅开展部分工序的验证、未对特殊条件下( 如混批、母液、回收溶剂、零头返工、中药材炮制) 的生产工艺进行验证、同步验证确少合理分析等; ( 5) 工艺验证前未要求对必要的条件进行确认,如制水系统确认情况、空气净化系统确认情况、人员培训和考核情况、物料供应商审计情况、分析方法验证或转移情况、计量设备测量范围和校准情况等。
2.3 验证记录与数据
验证记录与数据方面最核心的问题是数据可靠性问题,主要涉及数据管理基本原则: 可溯、清晰、同步、原始、准确、完整、一致、持久与可获得。最常见问题包括: ( 1) 记录信息不完整,如未记录工艺验证生产房间、设备、参数、全部操作人员、取样操作、过程中的偏差等信息; ( 2) 记录不可溯,如工艺验证记录涂改不规范、计算过程未记录等。
2.4 变更与再验证
由于设备老化、需求增加及质量改进等原因,药品生产条件不可能一直不变,这就需要做好变更控制和必要的工艺再验证。常见问题包括: ( 1) 重大变更未重新进行必要的工艺验证,如变更关键物料供应商、原料药生产工艺及质量标准变更、重大批量变更、新增或更换关键生产设备、调整生产处方、同期开展的多个变更共同作用可能对产品质量造成影响等;( 2) 基于变更启动的工艺验证未能证明变更的可行性,如仅进行 1 批产品的验证; ( 3) 变更启动的再验证未执行变更控制程序,如批量调整进行了工艺验证但未执行变更控制程序; ( 4) 再验证方面,涉及未规定再验证周期、验证到期前未及时开展工艺再验证等; ( 5) 基于变更启动的工艺验证尚未完成即对产品进行放行。
2.5 验证报告、结论与应用
验证报告是验证执行情况的总结,其中包括工艺验证的全部信息与结论,验证的结果必须与实际生产结合应用。常见问题包括: ( 1) 验证报告信息不全,如缺少对验证前状态确认情况、批量、物料加入量、关键操作时限、各工序收率、烘干翻盘次数、部分工序参数及中控结果等,未对 CPP 及 CQA 进行统计分析;( 2) 未依据工艺验证结果制定实际生产工艺,如物料过筛要求、冻干参数、搅拌速度与时间、干燥时间、微生物负载量监测、暂停生产的特殊要求等; ( 3) 验证结论与实际不一致,验证过程中个别项目( 如总混颗粒的粒度分布、素片外观等) 存在不符合标准的情况,验证结论却为通过。
2.6 验证方案
验证方案用于指导、规范工艺验证工作的开展,常见问题包括: ( 1) 验证方案中对取样规定不明确,如取样点、取样工具、样样品包装与储存、取样记录;( 2) 未规定验证前实施前必要条件的确认要求,如厂房、设施、设备及人员培训等; ( 3) 部分内容缺失,如未描述部分工序操作与参数设定、未规定中间产品验证期间的存放条件及时限; ( 4) 工艺验证方案与批生产记录、工艺规程之间部分信息不一致。
2.7 其他
其他方面的问题涉及持续工艺确认、工艺验证批留样、工艺验证中岗位职责规定等方面。常见问题包括: (1) 持续工艺确认存在不足,如未基于风险确认分析的频次与项目,未对 CPP 及 CQA 进行统计学的趋势分析以确认工艺处于受控状态[10] 等; (2) 未对批准前进行的工艺验证批进行留样; (3) 申报资料中工艺验证批检测结果与实际结果不一致; (4) 各部门关于工艺验证的职责描述不清晰,如生产部门职责规定中不包括工艺验证有关事项等。
第三部分 结语
科学、有效的工艺验证是确保持续稳定生产出符合预定用途和注册标准药品的重要措施,是证明药品质量始终一致的重要证明。通过本文有关分析,以期为制药行业进一步加强工艺验证提供参考,生产企业可以结合实际情况与本文中的常见问题进行对比分析,不断完善、提高工艺验证工作,进而更有效地保证药品质量。同时,也希望为药品检查工作提供借鉴,提高检查过程中对工艺验证有关问题的针对性。
第四部分 参考文献

来源:伟哥GMP
免责声明:文章版权归原作者所有。如涉及作品内容、版权和其它问题,请跟我们联系删除!文章内容为作者个人观点,并不代表本公众号赞同或支持其观点。本公众号拥有对此声明的最终解释权。

近期热门培训课题汇总
时间
(点击↓绿色字体链接阅读全文)
8月25-27日
9月7-9日
9月9-10日
9月19-21日
9月21-22日
9月21-23日
9月22-23日
9月22-24日
9月23-24日
9月23-24日
9月23-24日
9月23-24日
9月23-24日
10月13-14日
10月27-29日
录播视频
联系方式
扫描下方二维码或者点击“阅读原文”,登记信息后,会务人员将与您沟通培训相关细节。
参会及赞助宣传请联系负责人: 张洁15201506127(同微信)
报名QQ:2794867925

识别二维码在线报名
(收到报名表后,我们将第一时间与您联系)

(识别二维码添加会议负责人微信)

关注“食药技术苑”共同谱写中国食药研发新时代

戳这里,填写报名信息


