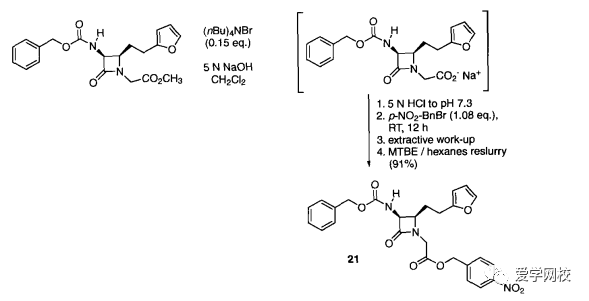
有机合成工艺优化--11.2产物纯化之重结晶(二)
11.2.3盐的选择

操作方式:加酸、碱或盐----成盐(沉淀、分层、溶解)----过滤、分液、加沉降剂沉降后过滤-----酸化(沉淀或分层)---过滤或萃取去除溶剂--干燥
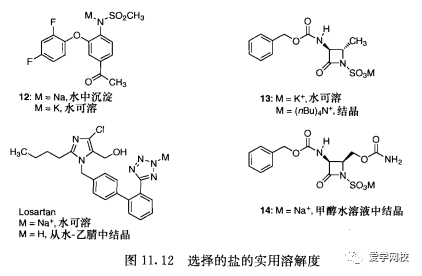
一些酸性化合物的盐的溶解度见图11. 12。在开发COX-II抑制剂时,Fujisawa 的员工利用了芳基磺胺12的钾盐和钠盐的不同溶解度[39]。粗品磺胺以钠盐的形式从水中沉淀(为了好的回收率,使用5当量的氢氧化钠盐析该中间体),经过酸化l,去离子的磺胺用二氯甲烷提取。用碳酸氢钠水溶液洗涤除去杂质,产物被萃取到氢氧化钾水溶液,再用活性炭处理。该条件下钾盐不会沉淀。酸化后,产物用异丙胺/水分离。取代的氨基磺酸13的钾盐是水溶性的,四叔丁基铵盐可以用有机相萃取并结晶[40]。类似的氨基磺酸钠14用水/甲醇结晶[41]。Losartan 以钠盐形式溶解于水,经过酸化可从水-乙腈中结晶[42]。这些试验表明酸性化合物和相应的盐的不同溶解度可方便的分离。
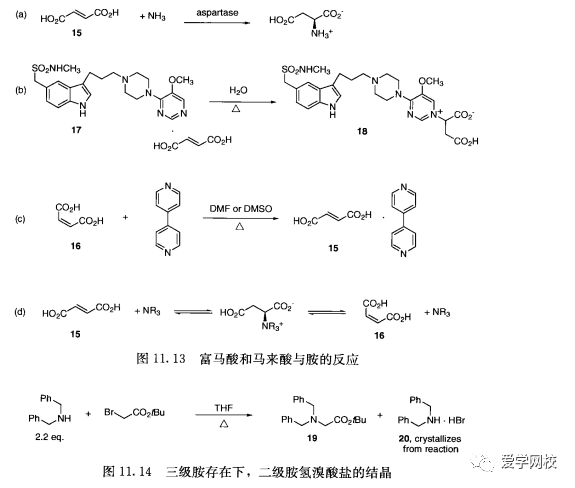
富马酸(15) 和马来酸(16) 被广泛用于制备原料药的盐,但是化学工作者需要知道这些化合物和胺类的反应性。a,β不饱和酯期望发生Michael反应,但是.一般不期望a, β不饱和酸发生Michael反应,如15和16。L天门冬氨酸在工业上是由酶催化氨对15的加成反应来制备(图11. 13 (a))[43]。在从BMS 180048富马酸盐(17) 制备的药物的加速压力研究中,主要杂质被确定为富马酸的加成物18 (图11.13 (b)[4]。马来酸与4,4-二吡啶在DMF或DMSO中共热异构化得到15 (图11.13 (c))[4]。这些数据表明在胺存在下,15和16可能存在平衡,特别在极性溶剂中,如水(图11.13(d))。与15和16成盐的原料药存在的平衡可能导致原料药的不稳定。其他酸,比如琥珀酸,对于制备稳定药物可能更有用。化合物的结晶性通常不如预期所想,除了结晶没有其他选择。在产生甘氨酸衍生物19(图11.14)时,仲胺盐20结晶并通过简单的过滤操作而除去[41]。碱性更强的叔胺19预期可与溴化氢结合产生结晶盐,但是在这个条件下过量的仲胺更易与溴化氢结合成盐。结晶能力的预期要与实验数据符合。
11.2.4通过实验室试验预期放大结晶工艺的能力
为便于操作,转移结晶产物的必要步骤要根据晶体的物理特征来决定。从结晶到过滤,料浆必须有很好的流动性。相对坚实的晶体,可用选择范围较宽的过滤器过滤得到。细小的晶体可能在压滤过程中破碎堵塞滤膜,该情况需要适当的选择过滤器以便于分离。小的、静电晶体难从过滤器转移到干燥器,以及从干燥器到储存装置。对于非理想状况,评价晶体特征和可行的操作规范见表11.5。放大反应操作需要与其他人讨论以选择最佳的过滤和分离设备。


112.5 洗涤和干燥 固体产物
结晶和打浆得到固体产物可进行湿饼的洗涤和干燥等操作。(1)洗涤湿饼有两个目的。最常见的用处是移除因母液而吸附在固体表面的杂质。洗涤溶剂的组成通常与结晶溶剂类似,以避免在湿饼上沉积杂质或者溶解产物。如果空气或者惰性气体,如氮气大量穿过湿饼,促进蒸发溶剂可能使之前溶解在母液中的杂质残留到产物晶体上。移除这种吸附的杂质需要增加洗涤溶剂和晶体的接触,以溶解并转移杂质。因此滤饼在洗涤之前不允许干燥。缓慢洗涤对于置换母液很重要。理想的洗涤溶剂体积是湿饼体积的1~2倍。通常洗涤温度是过滤温度,然而也可以使用其他温度。洗脱操作的效果需要通过IPC .检测(第7章)。洗脱产物的规则在表11. 6中列出。