药物产品往往被认为是多晶型或溶剂化物。氨曲南是一种无溶剂结晶形式和三个溶剂化物[16]。红霉素由两个无水多晶、九个溶剂化物[7]和“几乎所有药剂学上可接受的-切溶剂化形式”[18]结晶而成。劳拉西泮由多种多晶型和溶剂化物构成[19]。发现至少有14种多晶型和溶剂化物可作为有机染料,对优先形成的晶型付出努力越多,就有越多的多晶型和假晶型出现[13]。在发现纳他霉素第二晶型后,对其观察了35年[20],制备越多的中间产品或终产品,新的多晶型或溶剂化物形成的机会就越大。必须彻底了解结晶条件,才能确保持续制得理想的晶型或溶剂化物(见第11章)。
一个有较高熔点的多晶型物可能会表现出生物利用度差[21],这是由于在溶解过程中晶格能难以克服;然而,很少的上市药物会因为晶型不同而使生物利用度显示出重大差异[2]。选择一种多晶型时,稳定性、易于用化学方法制备、易于形成和生物利用度是首要考虑的因素。通常这些因素会导致热力学晶型成为原料药的首选形式。
制剂后,药物的有效成分在形态上的变化会对剂型产生深刻的影响。一种热力学稳定的晶型逐步形成会导致片剂解体[23];逐步水化也可能导致过渡到另一种晶型,给剂型造成相似的困难。
为了解决这些重要的固态问题,许多制药公司成立了一个经验丰富的小组,被誉为“结晶工程师”,以制定候选药物的适当形式,并制定准备这些材料的可靠程序。通常,一旦选中一种潜在的候选药物,在为毒理学研究进行第一批准备之前, 这个小组就介人研究。
FDA要求把稳定性测试作为大部分原料药及药物产品的新药申请(NDA)的一-部分。.稳定性测试的目的是为了建立药物产品的保质期,在保质期内它是有疗效的。在保质期内药效减少不能超过10%[24]。首选保质期是两年[21.25]。稳定性测试可以确定原料药的质量随时间如何变化,以及受温度、湿度和光度的影响。使用期限和研究条件应包括预期的储存时间、运输时间和原料药与药品的使用时间。在室温下样品分解缓慢,因此可以将样品放在高温条件下以预测保质期[25]。在稳定性研究中也会得到降解产物,这些物质会被认为是药物中的杂质。FDA建议的稳定性测试条件见表12. 1。
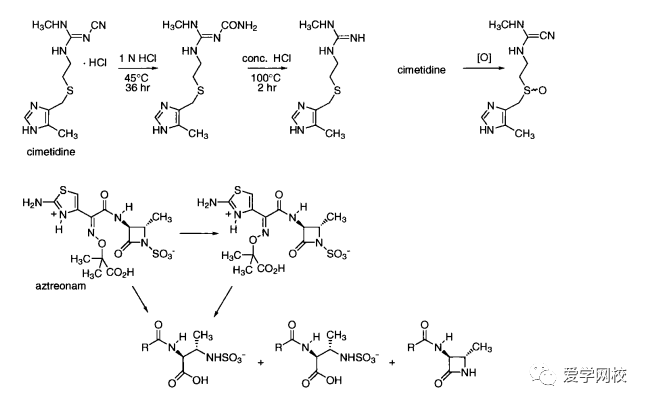
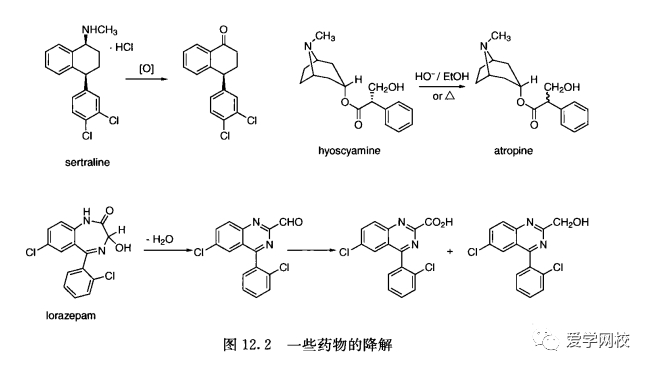
在发展一种潜在药物的早期,要进行大量稳定性测试,这样可以预知任何稳定性问题。然而,制定的原料药和辅料之间的相互作用也会影响药物产品的稳定性。因此,具有良好稳定性的原料药并不能保证药物产品具有良好的稳定性。原料药和药物产品的降解主要通过氧化降解和水解[26],并伴随脱水、光解、重排以及易挥发组分的流失如HCI”。化合物的稳定和不稳定是相对测试条件而言的,这可能比表12. 1所列的条件更苛刻。例如,西咪替丁室温下存放在密闭容器中,可以保存五年[2]。在pH为5.4和50°C时,西咪替丁不超过30天就会分解; 45C时,将西咪替丁放在NH4CI中保存36小时就会分解生成尿素(图12.2)。100°C下,在浓盐酸中加热两小时,就会形成胍。图12.2也显示了一些其他药物降解之后的产物[16.2830](酸碱盐低高温)
为了预测分子的稳定性,原料药分子结构中的官能团与辅料、溶剂和氧气的相互作用必须予以考虑。亲电和亲核反应官能团与邻近组分会发生分子间反应和分子内反应。官能团与辅料的反应也必须考虑[31],例如,不能将一个含有胺基化合物与糖配成药物,如甘露糖,因为可能会生成席夫碱[24]。根据分子中官能团之间可能会发生的反应,也可以预测化合物的稳定性。
粒度大小和分布非常重要,特别是在研制的早期阶段,为了确定最佳剂型要做大量的研究。小颗粒容易快速溶解,但由于表面积增加,小颗粒更容易分解(532]。小颗粒也容易凝聚,积累静电荷,因此流动很差33。可能需要研究相对生物利用度来判断是否要投人资源和时间来严格控制粒度大小和分布。
可通过结晶(见第11章)来控制粒径大小或通过铣削和磨削使粒径减小。铣削或磨削总是使一些产品留在设备中,从而降低原料药的产量(少量难以清除的固体原料药留在干燥机、磨粉机中)。在铣削过程中产生的热能可使原料药融化,这会给制剂过程中带来麻烦。颗粒减小会产生具有生物活性化合物的粉尘,增加操作人员的接触危险。通过结晶得到小颗粒晶体可避免使用机器减小颗粒径大小,但在分离过程中颗粒越小,过滤和洗涤就越慢。所以需要选择-种合适的设备或者发展一种最佳的分离晶体的方法。要怎样得到小颗粒晶体在研发过程中要仔细研究。
 总结:
总结:


