一、生物催化在制药行业的应用前景
(一)复杂药物合成的 “破局者”,应对高 PMI 挑战
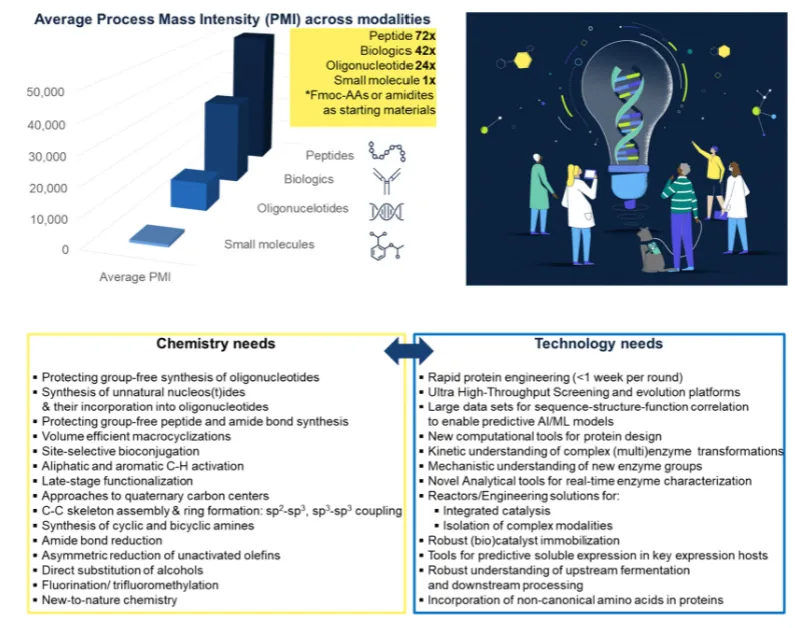
简化合成路线
通过酶的高选择性(如手性合成、位点选择性修饰),减少保护基 / 脱保护基步骤,缩短合成流程。例如,伊斯拉曲韦(Islatravir)的合成采用多酶级联反应,直接从简单原料构建复杂核苷结构,相比化学合成路线减少 50% 以上的反应步骤,PMI 显著降低。
攻克难合成片段
针对化学合成难以实现的碳 - 碳(C-C)键构建、环胺合成、非天然氨基酸引入等难题,酶催化可提供高效解决方案。例如,亚胺还原酶(IREDs)能高效合成手性仲胺(如 GSK-2879552 的关键中间体),烯还原酶(EREDs)可实现复杂环系的选择性还原(如 BMS-986278 的合成)。
(二)绿色可持续的 “核心工具”,契合行业发展刚需
减少 hazardous 试剂与废物
酶催化反应多在常温常压、 aqueous 体系中进行,无需使用重金属催化剂、强氧化 / 还原剂,从源头减少有毒有害物质的使用与排放。例如,西他列汀(Sitagliptin)的生物催化路线替代金属催化氢化,消除了重金属废物,相关工艺获 EPA 绿色化学挑战奖。
提升原子经济性
酶的高选择性可减少副反应,使原料更高效地转化为产品。据调研,酮还原酶(KREDs)、转氨酶(TAms)的规模化应用成功率分别达 41%、34%(图 3),显著高于行业平均水平,部分工艺原子经济性接近 100%。
(三)应用阶段 “前移化”,覆盖药物研发全流程
药物发现阶段
利用酶的多样性(如细胞色素 P450 单加氧酶)实现先导化合物的后期功能化,快速生成结构多样的衍生物库,加速药物筛选。例如,某企业通过 P450 催化的 C-H 键氧化,在实验室规模即可获得满足活性测试需求的中间体,无需规模化生产(图 6 “Scale-up not required” 类别)。
临床与商业化阶段
在药物临床阶段即引入生物催化路线,避免商业化后因工艺调整导致的成本激增与环境风险。例如,莫那匹韦(Molnupiravir)在临床阶段即采用工程化核糖激酶,实现高效合成,助力快速量产以应对新冠疫情。
二、工业生物催化在制药行业的未来方向
(一)酶工程技术:追求 “快速化、精准化”,突破性能瓶颈
快速蛋白工程平台
开发每轮优化 < 1 周的高通量筛选技术(如微流控筛选、超高通量自动化系统),结合 2024 年诺贝尔化学奖相关的蛋白结构预测工具(如 ProteinMPNN),缩短酶进化周期。例如,通过 AI 预测酶的关键突变位点,可将酶活性优化周期从传统的 6 个月缩短至 2 周内。
精准功能定制
针对制药行业对酶的严苛需求(如高底物耐受性、宽 pH 适应性、低宿主蛋白干扰),利用机器学习辅助酶设计(图 92-96),实现 “按需定制”。例如,通过训练酶序列 - 结构 - 功能数据集,可预测特定底物对应的酶突变体,减少试错成本。
(二)应用场景:从 “单一转化” 到 “复杂模态与新化学空间”
复杂药物模态的突破
针对寡核苷酸、肽类药物、生物偶联药物等复杂模态,开发专用酶催化技术。例如,开发无保护基寡核苷酸合成酶,解决当前化学合成中试剂消耗大、纯化复杂的问题;利用肽连接酶实现长链肽的高效合成,替代传统固相合成。
“非天然化学” 的探索
通过酶工程与化学修饰结合,开发能催化 “非天然反应” 的酶(如结合光催化 / 电催化的人工酶),突破自然界酶的催化局限。例如,设计能催化新型 C-X 键(X 为氟、硫等)的酶,为含氟药物(如抗肿瘤药物)的合成提供绿色路径。
(三)工艺工程:提升 “规模化效率”,解决工程化痛点
高浓度与低负载工艺
开发高底物浓度(>100 g/L)反应体系,结合固定化酶技术(如亲和标签捕获、新型载体材料),降低酶负载量(目标 < 2 wt%),提升体积效率以降低 PMI。例如,某企业通过固定化转氨酶,在填充床反应器中实现底物浓度 80 g/L 的连续流合成,酶重复使用 10 次以上。
多酶级联与集成化工艺
推广多酶级联反应(如 ERED/KRED 级联、激酶 - CGAS 级联),通过 “一锅法” 消除中间产物分离步骤,减少损耗。同时,将酶催化与反应 - 精馏、反应 - 结晶等工程技术集成,实现 “反应 - 分离 - 纯化” 一体化,进一步提升流程效率。
(四)技术生态:“协同化与平台化”,降低应用门槛
跨学科协同
加强 “合成化学 - 生物学 - 工程学 - 计算科学” 的交叉合作,例如,酶工程师与反应器设计师共同开发适配酶催化的连续流设备,解决酶在动态反应中的稳定性问题。
平台化服务
建立商业化酶库与工程服务平台,为缺乏自主研发能力的企业提供 “酶筛选 - 优化 - 规模化” 全链条服务。例如,某供应商已推出涵盖 500 + 酶的筛选试剂盒,支持快速匹配特定转化需求,降低中小企业应用成本。
(五)政策与标准:“规范化与绿色导向”,引导行业发展
绿色认证与激励
未来可能出台针对生物催化工艺的绿色认证标准(如降低碳足迹 20% 以上可获政策补贴),进一步推动行业 adoption。例如,EPA 绿色化学挑战奖、GCIPR Peter J. Dunn 奖等将持续引导企业投入生物催化研发
监管标准完善
针对酶的生产、纯化、质量控制制定统一标准(如宿主蛋白残留限值、酶稳定性测试方法),解决当前行业 “标准不统一” 导致的规模化障碍。例如,建立固定化酶的生命周期评估(LCA)标准,量化其环境效益,为工艺选择提供依据。


