从早期研发到当代流体动力学革新
1. 历史沿革:从治疗性球囊到通路保障的演进
球囊导引导管(BGC)理念、材料和技术的发展充分体现了神经介入的历史。
1.1 可脱卸球囊(DBC)的开创性时代(1970s-1990s)
BGC的技术源头可以上溯到神经介入的最早年历史。费奥多尔·谢尔比年科(Fedor Serbinenko)是一位苏联神经外科医生,被誉为“血管内神经外科之父”。1959年莫斯科红场的国际劳动节庆祝活动中,谢尔比年科在观看儿童用系绳操控氦气球时,开始构想小型球囊在迂曲动脉中移动的场景。 通过持续实验,他逐步完善了技术,使用乳胶或硅胶等材料制作不同尺寸的球囊,以适应各种血管病变,如颈动脉海绵窦瘘和脑动脉瘤。 1974年,谢尔比年科在《神经外科杂志》(Journal of Neurosurgery)上发表了开创性论文,详细描述球囊导管在主要脑血管闭塞中的应用,首次报道可脱卸球囊 (DBC) 用于永久闭塞血管的技术。因此,他可以被认为是第一位介入神经放射学家。此后,该技术由世界各地的神经放射学家,主要在法国,得到进一步完善,介入神经放射学在法国得以发展并壮大。

Fedor Serbinenko(1928-2002)
通过导管将球囊置入目标位置,充气后脱卸,从而实现精确的血管闭塞,同时最大限度地减少对周围组织的损伤。 DBC技术的出现,为那些无法通过传统神经外科手术夹闭或切除的高流量血管病变提供了微创治疗的可能。在苏联布尔坚科神经外科研究所(Burdenko Neurosurgical Institute),他成功应用这一技术治疗了数百例患者。 这一发明不仅解决了传统外科手术的高风险问题,还为后续技术如血管内弹簧圈和支架的发展奠定了基础,也是BGC的最初技术源头。
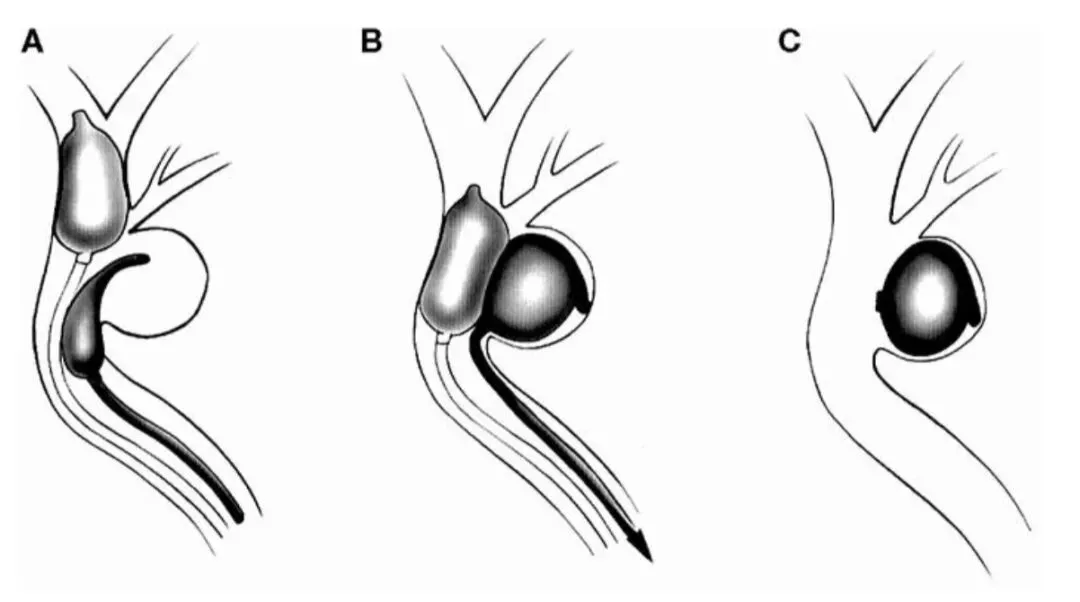
Serbinenko提出的动脉瘤球囊栓塞技术
尽管随着Guglielmi可脱卸弹簧圈(GDC)、液体栓塞剂(如Onyx)以及后来的血流导向装置(Flow Diverter)的出现,DBC逐渐退出了历史舞台,但这一时期的探索确立了球囊在颅内血管导航的可行性,并积累了关于球囊材料顺应性、充盈压力控制以及血管壁相互作用的宝贵经验。这种“顺流而下”的导航理念,后来演变为现代远端通路导管(Distal Access Catheter, DAC)和BGC在复杂解剖结构中应用的基础。
谢尔比年科的工作在1970年代震惊了国际神经外科界,推动了血管内治疗从实验阶段向临床应用的转变。 尽管面临冷战时期的国际交流限制,他的贡献最终被广泛认可,并影响了当代神经介入手术的标准实践。

1.2 颈动脉支架术的近端栓子保护
在颈动脉支架置入术(CAS)中,栓子保护装置(Embolic Protection Devices, EPDs)是手术安全的核心。其主要目的是拦截或移除术中因球囊扩张或支架植入而脱落的斑块碎屑,从而降低围术期缺血性卒中的风险。近端保护装置(如 MoMa)与缺血性卒中取栓手术中所使用的球囊导引导管(BGC, Balloon Guide Catheter),在设计逻辑和血流动力学原理上具有高度的血缘关系。MoMa 的成功研发为 BGC 的技术演进和临床应用提供了启示。
| 远端滤网装置 | ||||
| 远端球囊阻断 | ||||
| 近端保护装置 | 在接触病变前建立保护 |
远端滤网装置 (Distal Filter Devices) ?️
这是目前临床上最常用的保护装置。其核心是一个安装在导丝远端的微孔滤网。
• 工作原理: 滤网孔径通常在 100μm100μm 至 150μm150μm 之间。在支架扩张过程中,大块碎屑会被滤网捕获,而血液(红细胞)仍能顺向流过,维持大脑供血。 • 临床评价: 操作相对直观,符合介入医生的习惯。但它的“先天缺陷”是必须先让装置穿过狭窄斑块(Crossing the Lesion)才能建立保护,这个过程本身可能导致斑块脱落。
远端球囊阻断系统 (Distal Occlusion Systems) ?
这是较早期的技术,通过在病变远端充盈一个顺应性极好的小球囊来物理性地封堵血管。
• 工作原理: 球囊完全阻断血流,使碎屑停留在病变段血管内。在支架植入完成并回收球囊前,医生通过抽吸导管将含有碎屑的血液吸出。 • 临床评价: 虽然保护效果比滤网更彻底(拦截所有尺寸碎屑),但由于它会完全中断该侧大脑血流,约 5%-10% 的患者因为侧支循环不佳而无法耐受。
近端保护装置 (Proximal Protection Devices) ?️
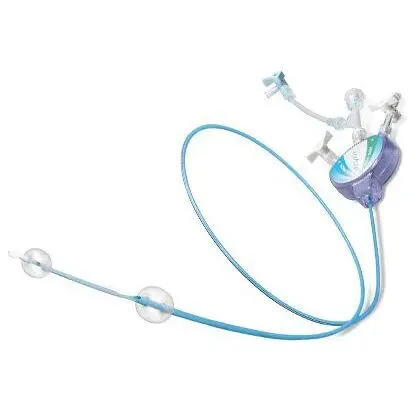
代表性为 MoMa 装置,其理念促进了BGC以及TCAR术式的发展。
• 工作原理: 通过在颈总动脉(CCA)和颈外动脉(ECA)分别充盈球囊,在病变段近端建立阻断。通过压力差或负压抽吸形成“血流逆流”,让碎屑根本无法进入内动脉远端。 • 临床评价: 它是唯一能实现“零风险穿过”的装置,尤其适用于含有大量血栓或极其不稳定的“高危斑块”。
MoMa装置对BGC的启发
A. 从“过滤”到“阻断”的思维转变
在 MoMa 出现之前,CAS 保护的主流是远端滤网(Filter)。MoMa 证明了:与其被动地过滤已经掉落的碎屑,不如主动地改变血流动力学状态。
• 对 BGC 的启示: 在取栓过程中,血栓受支架取栓器(SR)或吸导管挤压极易发生碎屑脱落。BGC 借鉴了 MoMa 的“阻断”逻辑,通过在颈总或颈内动脉近端临时充盈球囊,停止顺向血流。这种主动干预比单纯在远端等待捕获血栓碎屑更具前瞻性。
B. 建立“血流逆流”机制(Flow Reversal)
MoMa 最核心的价值在于通过压力差实现血流逆流。
• 对 BGC 的启示: 仅仅阻断血流是不够的。BGC 的研发重点在于配合远端抽吸。当 BGC 球囊充盈(阻断顺向流)+ 远端抽吸(建立负压)时,血管内会形成一个类似 MoMa 的逆流真空环境。 • 效果转化: 这种机制确保了在拉出支架或血栓的一瞬间,脱落的细小碎片会顺着逆流方向进入抽吸导管,而不是随着恢复的顺向血流冲入远端微血管。
1.3 机械取栓早期的通路挑战与BGC的诞生
进入21世纪,随着急性缺血性卒中血管内治疗的兴起,最初的焦点在于如何将溶栓药物或早期的机械取栓装置(如Merci螺旋取栓器)输送到闭塞部位。导引导管是主要的通道器材,但在操作过程中,可能发生的血栓碎片脱落导致远端栓塞,这是限制临床预后的主要因素之一。
借鉴颈动脉支架置入术(CAS)中近端球囊保护装置的经验,神经介入医师开始尝试在取栓过程中使用带有球囊的导引导管。Merci Balloon Guide Catheter (BGC) 是神经介入治疗领域的先驱性产品,是全球首个专门为急性缺血性卒中机械取栓设计的球囊导引导管。Merci BGC 的诞生主要基于以下研发动机:

Merci Retriever
• 配套 Merci Retriever(Merci 取栓器): 2004 年,Concentric Medical 公司研发的 Merci Retriever 成为首个获 FDA 批准的取栓器。由于这种螺旋形装置在拉出血栓时极易造成血栓破碎,研发团队意识到,必须在近端提供一个“屏障”来防止碎屑随血流冲向远端。 • 血流动力学的利用: 借鉴了颈动脉支架术(CAS)中 MoMa 等近端防护装置的成功经验,Merci BGC 的初衷是通过在颈内动脉(ICA)近端临时阻断血流,改变压力梯度。 • 解决“远端栓塞”痛点: 早期临床发现,单纯使用常规导管取栓,约有 10%-15% 的病例会出现碎裂栓子掉入新血管区域(Emboli in New Territory)。BGC 的设计目标就是将这种风险降至最低。

Merci Balloon Guide Catheter
虽然 Merci Retriever(取栓器本身)后来被更先进的支架取栓器(如 Solitaire)所取代,但 Merci BGC 所开创的“球囊导引”理念却成为了长青树。Merci BGC 的研发是一个飞跃,在处理急性脑梗死时,“控制血流”与“移除血栓”同等重要。尽管 Merci 这一品牌已逐渐淡出器械一线,Merci BGC 的出现开启了 BGC 技术的时代。Merci BGC内径小,导管较硬,球囊顺应性一般,随后的产品(如 FlowGate, Cello, Walrus 等)都是在其基础上进行了改进。Merci BGC留下的“近端阻断+负压抽吸”的技术规范,至今仍是各大国际卒中指南推荐的高级别操作准则。
| 内径大小 | ||
| 柔韧性 | ||
| 球囊材料 |
1.4 现代BGC的定型与FlowGate2的崛起
随着支架取栓支架(Stent Retriever)如Solitaire和Trevo的问世,机械取栓成为标准治疗,对BGC的性能要求也随之提高。Stryker Neurovascular推出的FlowGate2球囊导引导管标志着现代BGC时代的到来。与早期产品相比,FlowGate2在保持8F外径(OD)的同时,将内径(ID)扩大至0.084英寸,并采用了不锈钢双层编织结构,显著提升了抗折性和通过性。这一设计平衡了近端支撑力与远端柔顺性,使得BGC能够更安全地放置在颈内动脉高位,甚至通过原本难以进入的解剖结构。
此后,BGC的角色从单纯的“通路”转变为“主动流量控制系统”。临床研究开始大量涌现,证实了配合BGC使用支架取栓可以显著提高首过再通率(First Pass Effect, FPE)。这一时期,BGC不再是可选项,而是被越来越多的专家共识推荐为首选通路方案。
尽管在支架取栓时代,BGC的获益已得到较为充分的验证,但在大口径抽吸导管(Large Bore Aspiration Catheter)——特别是内径达到0.070英寸甚至0.088英寸的“超大口径”导管——普及的今天,BGC是否依然不可或缺 ? 一种观点认为,现代大口径导管已能产生足够的抽吸力并占据大部分血管截面,从而产生“类BGC”的局部血流阻断效应,因此可以摒弃BGC以简化流程;另一种观点则坚持认为,无论抽吸导管口径如何增大,BGC所提供的近端血流阻断和逆流效应对于保障手术安全(特别是减少异位栓塞)和提高一次通过效应(FPE)仍具有不可替代的价值。
2. 流体动力学机制与工作原理
BGC在神经介入中的核心价值在于其对局部血流动力学的重构。传统的导引导管在取栓时,血管内仍保持着动脉血压驱动的前向血流,不仅增加取栓的物理难度,还明显增加栓塞风险。BGC通过物理阻断和压力梯度的改变,从根本上优化取栓环境。
2.1 近端血流阻断(Proximal Flow Arrest)
当BGC顺应性球囊在颈内动脉充盈时,直接的效应是造成前向血流完全停滞,不仅仅是简单的“关门”,而且深刻改变作用于血栓的力学环境。
在无球囊阻断情况下,收缩压直接作用于血栓近心端表面。对于一个嵌顿在大脑中动脉M1段的血栓,这种持续的“水锤效应”(Water Hammer Effect)会将血栓压得更紧,增加血栓与血管壁之间的摩擦力,即所谓的“嵌顿力”(Impaction Force)。BGC充盈后,阻断了来自于心脏的压力传递,使得血栓近端压力急剧下降,从而显著降低跨血栓压力梯度(Pressure Gradient, \Delta P)。
根据流体力学原理,取栓装置(无论是支架还是抽吸导管)需要克服的阻力主要由血栓与血管壁的摩擦力决定,而摩擦力又与嵌顿力正相关。通过消除近端前向血流导致的高压,BGC可以有效地“松动”血栓,使得支架取栓器在回撤时所需的牵拉力减小,同时也减少血栓在被拉出过程中碎裂的可能性。
2.2 血流逆转(Flow Reversal)与“吸尘器效应”
如果说血流阻断是防御性的,那么血流逆转则是进攻性的。在球囊充盈阻断前向血流的同时,术者通过BGC 进行强力抽吸(手动使用60ml注射器或连接负压泵),在BGC头端制造一个强大的负压区。
由于Willis环存在,负压会诱导来自大脑前动脉(通过前交通动脉)或大脑后动脉(通过后交通动脉)的侧支血流发生逆流,流向BGC头端。这种逆向血流形成一个冲刷机制。在取栓支架捕获血栓并将其拉回导管的关键时刻——也就是所谓的“剥离阶段”(Shearing Phase),血栓极易因为受到导管头端的机械挤压而破碎。在传统GC模式下,这些碎片会随前向血流漂向未受累的远端血管(如ACA或MCA M3/M4段),造成“新区域栓塞”(Emboli to New Territory, ENT);而在BGC模式下,逆向血流将血栓碎片吸入BGC内,彻底清除出体外。
体外硅胶血管模型(In-vitro Silicone Vascular Replicas)的粒子图像测速(PIV)研究直观地证实了这一点:在BGC充盈并抽吸时,导管尖端周围的流场完全指向导管内部,甚至在支架取栓器完全撤出后,持续的抽吸仍能清除悬浮在血液中的微小血栓颗粒。
2.3 “闭环系统”与抽吸效率
BGC的另一个流体力学优势是构建相对封闭的液压系统。在使用接触性抽吸(ADAPT技术)时,如果使用常规GC,抽吸泵的负压会同时作用于血栓和近端的开放血流,血液会可能从近端被吸入,从而削弱了作用于血栓表面的真空吸力(Vacuum Effect)。
通过阻断颈内动脉的近端血流,BGC可以将血栓近端的流体静压降至接近零(或显著低于系统收缩压),从而极大减少跨血栓的压力梯度。在BGC保护下,抽吸泵产生的负压几乎可以全部转化为有效移除力,而无需“分心”去对抗前向血流的推力。多项体外流体力学研究证实,在相同口径的抽吸导管下,联合使用BGC能显著降低血栓移位所需的临界负压值,并增加血栓被完整捕获的概率 。
支持在大口径抽吸中弃用BGC的学者常引用“软木塞效应”(Corking Effect)。其理论依据是,当抽吸导管的外径(OD)接近目标血管(如大脑中动脉M1段)的内径时,导管本身就能起到阻断血流的作用。例如,0.088英寸的导管外径约为2.8mm-2.9mm,这与许多M1段的直径相当。此时,导管本身即充当了阻断球囊的角色 。 然而由于所谓的“台阶效应”(Ledge Effect)的存在,在实际操作中,导管与血管壁之间很难达到完美的密封。尤其是在导管推进过程中,或者当导管并未完全贴合血栓表面时,导管与血管壁之间会存在环形间隙。即便这个间隙很小,在高压动脉血流的驱动下,依然会有显著的血流通过。
此外BGC充盈后形成的“闭环”设计还可防止在造影剂注射或其他操作中因压力波动导致的血栓移位。
3. 器械工程学与市场格局分析
随着BGC临床价值确认,各大医疗器械厂商纷纷投入资源进行产品迭代。现代BGC设计是一个在兼容性、支撑力和柔顺性之间寻求平衡的工程学挑战。
3.1 核心设计参数与材料科学
BGC通常由三层结构组成:内层的润滑涂层(PTFE衬里)、中间的加强层(金属编织或线圈)以及外层的聚合物护套。
• 编织与线圈(Braid vs. Coil): 为了在保持抗折性的同时提供足够的扭控性(Torqueability)和推力(Pushability),FlowGate2等主流导管采用不锈钢双层编织技术。这种结构使得导管在充盈球囊时能够抵抗血流冲击而不发生移位。相比之下,部分远端通路导管采用线圈加强以增加柔顺性,支撑力可能受到影响。BGC采用线圈结构时可能牺牲一定的近端支撑力。 • 球囊材料: 现代BGC普遍采用顺应性极佳的硅胶或聚氨酯材料。例如,Q’Apel Walrus的球囊由聚氨酯制成,最大直径可达11.1mm,能够适应从颈总动脉到颈内动脉不同管径的血管壁,且在充盈时对血管壁的压力分布更均匀,减少损伤风险。 • 可变刚度轴杆(Variable Stiffness Shaft): 为了顺利通过迂曲的颈动脉虹吸段,BGC通常设计有多个硬度过渡区。近端较硬以提供支撑,远端逐渐变软以适应解剖结构。FlowGate2设计了五个过渡区,而Walrus则引入了根据导管位置改变刚度的技术。
3.2 主流BGC器械深度横向评测
市场上的BGC产品主要根据其内径大小和兼容性进行细分。目前,“大内腔”是竞争的焦点,目的是为了兼容新一代的0.070英寸甚至更大的中间导管。
Stryker FlowGate2 —— 行业标杆
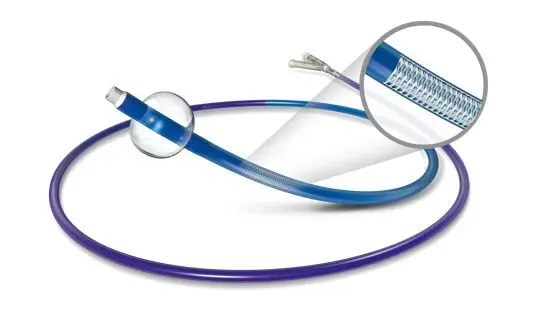
• 规格: 8F外径(0.106英寸),0.084英寸内径,工作长度85cm或95cm。 • 特点: FlowGate2是目前临床应用最广泛的BGC,被视为“金标准”。其0.084英寸的内径足以容纳大多数常规抽吸导管(如Stryker Catalyst 6, MicroVention Sofia 5F/6F)。其球囊充盈体积约为0.6ml时直径可达10mm。 • 局限: 面对最新的0.071英寸以上超大内腔抽吸导管(如Zoom 71, Sofia Plus),FlowGate2的空间可能显得捉襟见肘,摩擦力较大,限制了“BGC+大抽吸”双重技术的应用。
Medtronic Cello —— 传统选择
• 规格: 提供8F和9F两种版本。8F版本内径仅为0.075英寸,9F版本内径为0.085英寸。 • 特点: Cello是较早期的产品,曾在Solitaire相关试验中广泛使用。 • 局限: 其8F版本的内径较小,无法兼容现代主流的中间导管,导致其在“直接抽吸首选”(ADAPT)技术盛行的当下市场份额有所下降。使用9F版本虽然解决了内径问题,但增加了腹股沟穿刺点的并发症风险。
MicroVention Bobby —— 针对性优化
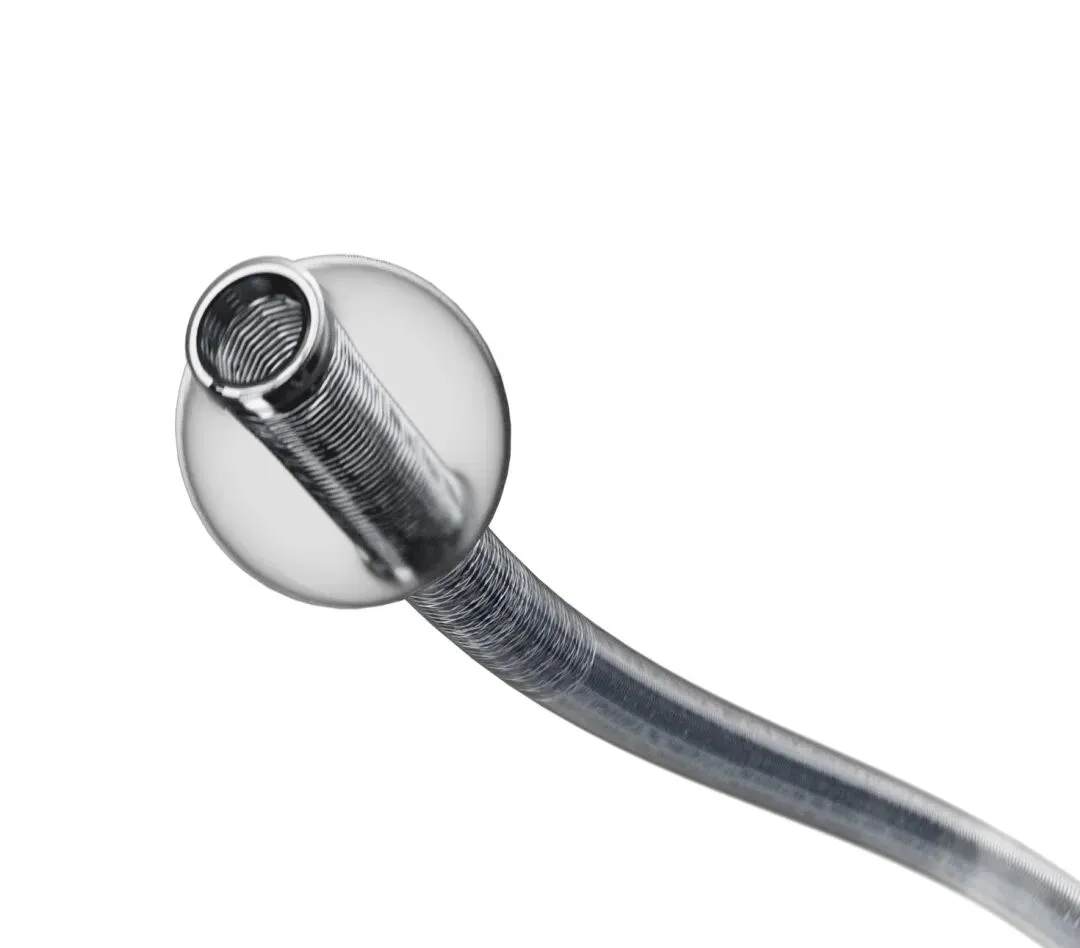
• 规格: 8F外径(约0.110英寸),0.086英寸内径,95cm长度。 • 特点: Bobby的设计初衷就是为了配合MicroVention自家的Sofia Plus(外径0.070英寸)使用。其0.086英寸的内径为Sofia Plus预留了足够的间隙,减少了推送阻力。此外,Bobby采用了特殊的抗扁平化(Anti-ovalization)设计,防止在强力抽吸或弯曲时管腔塌陷。 • 市场定位: “下一代”BGC,强调流线型工作流和对大孔径导管的兼容性。
Q‘Apel Walrus —— 追踪性与大内腔之王
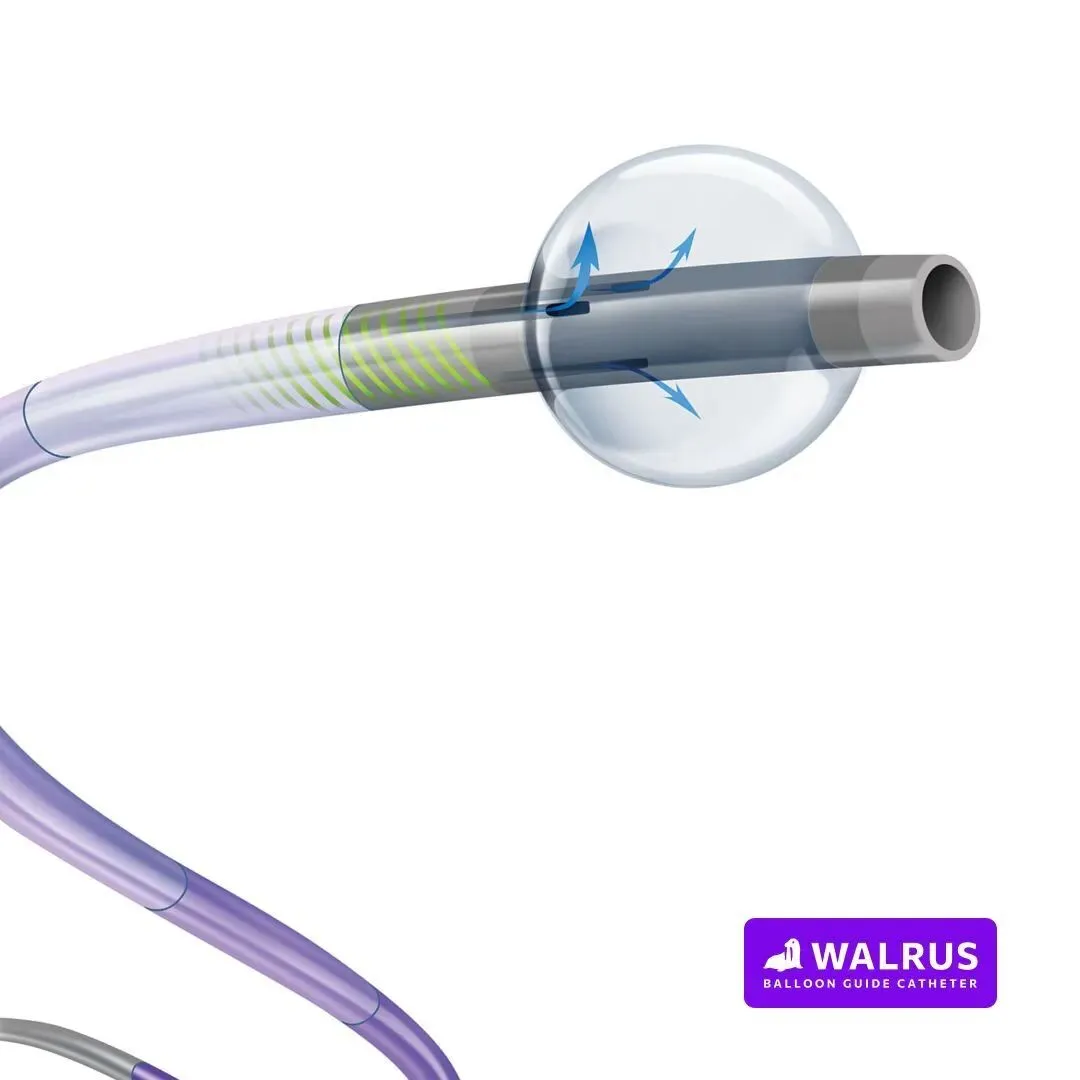
• 规格: 标称8F+(外径0.110英寸),内径达到惊人的0.087英寸。 • 特点: Walrus以其卓越的追踪性(Trackability)著称,能够在极度迂曲的血管中爬升。其0.087英寸的内径是同级别中最大的之一,理论上可以兼容市面上几乎所有的 6F 外径抽吸导管,包括Zoom 71。其球囊顺应性极高,最大直径11.1mm,适应性强。 • 临床评价: 许多术者在面对困难弓型或需要极致高位支撑时偏爱Walrus。
Cerenovus Emboguard —— 系统集成的产物
• 规格: 外径0.112英寸,内径0.087英寸。 • 特点: 这是Johnson & Johnson / Cerenovus最新推出的BGC,旨在与其Embotrap III取栓支架和Cerebase导管形成完整的“中风解决方案”(Stroke Solutions)。其设计重点在于与Embotrap的协同作用,优化取栓过程中的血流控制。 • 意义: 标志着巨头厂商意识到BGC在整体解决方案中不可或缺的地位,试图通过闭环生态系统锁定用户。
Phenox/Wallaby Paragon
• 规格: 实质上等同于FlowGate2,8F外径。 • 定位: 在欧洲和部分亚洲市场作为FlowGate2的有力竞争者,提供相似的性能参数。
3.3 规格参数对比表
4. 临床证据:注册研究、Meta分析与争议
BGC之所以能成为目前的推荐,并非仅仅基于流体力学理论,而是基于近十年来积累的大量证据。这些证据从早期的单中心报道,发展到大规模多中心注册研究,再到系统评价和Meta分析,构建了证据链,所缺乏的是高质量的临床随机对照研究(RCT)。
4.1 注册研究的里程碑:NASA与STRATIS
两项具有里程碑意义的真实世界注册研究为BGC的优越性提供了最初的强力证据。
NASA注册研究 (North American Solitaire Acute Stroke Registry): 该研究分析了前循环大血管闭塞患者使用Solitaire支架取栓的数据。
• 临床预后: 多变量分析显示,使用BGC是90天良好临床预后(mRS 0-2分)的独立预测因子,其比值比(Odds Ratio, OR)高达2.0(95% CI 1.3-3.1, p=0.001)。 • 死亡率: BGC组的死亡率显著低于非BGC组(13% vs 23%, p=0.008)。 • 意义: 这是首个大规模证实BGC不仅能改善血管再通,还能切实转化为患者生存获益的研究。
STRATIS注册研究 (Systematic Evaluation of Patients Treated with Neurothrombectomy Devices): 这是一项规模更大的前瞻性非随机观察性研究,涵盖了近千名患者。
• 首过效应(FPE): 研究发现,BGC组实现“首过再通”(即一次操作达到TICI 2c/3级血流)的比例为66.4%,显著高于常规导管组(41.9%)和远端通路导管组(54.9%)。 • 功能独立: BGC组90天功能独立(mRS 0-2)的比例为61.0%,显著优于CGC组(41.8%)和DAC组(51.8%)。 • 机制验证: STRATIS数据有力地支持了“近端血流控制减少远端栓塞从而提高一次性成功率”的假设。在多变量分析中,调整了年龄、基线NIHSS评分、闭塞部位等因素后,BGC依然是预后良好的强独立预测因子。
4.2 系统评价与Meta分析的共识
Brinjikji、Nguyen等学者进行的系统综述和Meta分析汇总了数千例患者的数据,结果具有高度的一致性:
• 再通率与安全性: BGC使用与更高的最终再通率、更短的手术时间以及更低的远端栓塞率相关。 • 首过效应(FPE)的关键驱动力: FPE被认为是预测卒中预后的最强指标。Meta分析显示,BGC使得获得FPE的几率增加约一倍(OR ~2.0)。相比于虽然最终再通但经历了多次尝试的患者,FPE患者的血管内皮损伤更小,造影剂用量更少,缺血时间更短,因此预后更好。
4.3 临床随机对照试验引发的争议
尽管长期的观察性研究(如NASA、ROSSETTI注册研究)一致认为BGC是提高开通率和改善预后的“金标准”,然而针对AIS机械取栓中BGC的随机对照研究(RCT),如最近发表的两项关键RCT研究(PROTECT-MT和ProFATE)挑战了这一观点。
A. PROTECT-MT 试验 (2024年) ?
这是目前规模最大、也是最具争议的关于BGC的随机对照研究。
| 研究地点 | |
| 发表期刊 | |
| 对比组 | BGC组 |
| 核心结果 | |
| 主要发现 | |
| 研究状态 | 提前终止 |
• 深度剖析与归因: 结果与NASA、STRATIS截然相反,学界分析认为可能存在以下原因:a. 病因学差异: 亚洲人群中颅内动脉粥样硬化性狭窄(ICAD)引起的闭塞比例远高于西方人群(后者多为心源性栓塞)。对于ICAD病变,主要问题是原位狭窄而非单纯的血栓负荷,BGC的防栓塞机制获益有限,而其本身的操作复杂性可能带来额外风险。b. 器械因素: 该试验使用了中国国产的SeparGate球囊导管。有观点质疑该器械的性能(如顺应性、头端设计)是否达到了FlowGate2或Walrus等国际一线品牌的水准,导致了更高的血管痉挛和夹层风险。c. 学习曲线: BGC的操作技术要求高于CGC。如果参与中心的部分术者对BGC置入、充盈时机掌握不熟练,可能导致手术时间延长或血管损伤,抵消了其理论优势。
PROTECT-MT结果提示BGC并非万能神器,其获益可能高度依赖于特定的病理生理机制(栓塞 vs 狭窄)以及术者的操作经验和器械质量。
重点:该研究中约27%的患者患有颅内动脉粥样硬化性狭窄 (ICAD)。批评者指出,对于依赖侧支循环的ICAD患者,BGC导致的血流中断可能加重缺血,这可能是导致不良预后的重要原因。
B. ProFATE 试验 (2024年)
这是另一项旨在验证BGC血流阻断效果的RCT。
| 研究地点 | |
| 对比组 | BGC充盈阻断组 |
| 主要终点 | |
| 核心结果 | 无显著差异 |
| 次要发现 |
结论:虽然BGC在减少碎栓和提高技术成功率方面有优势,但在该研究样本量下,这些技术优势并未转化为90天临床功能的改善。
? 证据对比:观察性研究 vs. RCT研究
目前的医学界正处于对BGC价值的重新评估期。
| 临床预后 | ||
| 血管再通 | ||
| 安全性 | ||
| 结论地位 |
? 临床启示与总结
1. 人群差异:BGC可能更适合心源性栓塞(血栓较脆、易碎),而对于中国人群高发的ICAD(原位狭窄、依赖侧支),使用BGC需非常谨慎。 2. 技术配合:BGC在配合支架取栓 (Stent Retriever) 时优势最明显,但在单纯抽吸 (Direct Aspiration) 或配合大型抽吸导管时,其技术操作的延迟可能抵消其血流阻断带来的益处。 3. 指南动态:虽然目前的欧美指南仍倾向于推荐BGC,但随着2024年RCT证据的更新,未来指南可能会根据栓塞原因或血管解剖对BGC的使用进行更精细的分层推荐。
5. 颠覆与融合:“超大内腔”导管与BGC的路线之争
当前神经介入领域最激烈的技术辩论之一,是坚持使用BGC进行近端阻断,还是转向使用 超大内腔(Super-bore) 导管进行强力抽吸?
5.1 ADAPT技术的进化与BGC的物理局限
直接抽吸首过技术(ADAPT)的核心理念是:导管内径越大,抽吸力越强(根据泊肃叶定律,流量与半径的四次方成正比),取栓成功率越高。
• 冲突点: 传统的BGC(如FlowGate2,ID 0.084”)受限于8F外径,无法容纳最新的0.088“级别抽吸导管(如Zoom 88, OD ~0.105”)。 • 取舍: 术者面临两难选择:是选择BGC带来的血流控制安全感(但只能用较细的0.070/0.072“抽吸导管),还是选择长鞘(Long Sheath)带来的极致抽吸力(可以使用0.088”导管,但没有球囊阻断)?
5.2 0.088“ 系统的崛起:Zoom 88 与 Route 92
以Imperative Care的Zoom 88和Route 92 Medical的HiPoint系统为代表的“超大内腔”导管正在挑战BGC的地位。
• Zoom 88: 这是一个拥有0.088英寸内径的导管系统。虽然它不是BGC,但其设计理念是将导管尖端直接送至颅内(ICA末端或M1近端)。厂商宣称,凭借其巨大的吸力,可以在局部形成足以压倒血流的真空场,从而替代球囊的阻断作用。 • Route 92 HiPoint: 采用了独特的Tenzing输送技术,旨在将0.088英寸导管快速送达病变部位。其SUMMIT MAX临床试验正在直接对比这种“超级抽吸”策略与传统疗法的效果。初步数据显示,这类大孔径导管在特定情况下能实现极高的再通率。
5.3 融合趋势:大内径BGC的反击
为了应对ADAPT的挑战,BGC制造商正在努力扩大内径。
• Walrus和Emboguard的策略: 它们将内径推至0.087英寸,试图勉强兼容更大的抽吸导管。虽然仍难以完美适配0.088”系统,但已经能够容纳Zoom 71、Sofia Plus等次顶级抽吸导管,试图提供“BGC + 强力抽吸”的折中方案。 • 未来形态: 理想的终极形态可能是一款拥有0.090“+内径且外径不显著增加的BGC,但这需要材料科学的重大突破(如更薄但更强的管壁材料)。
6. 卫生经济学影响与未来展望
6.1 成本效益分析:昂贵但值得
BGC的单价通常高于普通长鞘,这在成本敏感的医疗体系中是一个考量因素。然而,基于全周期的卫生经济学分析支持BGC的使用。
• 数据支持: 2024年一项涵盖美国、加拿大和欧洲七国的研究表明,尽管BGC增加了手术耗材成本,但由于其提高了FPE率,减少了补救性治疗(如额外支架、溶栓药物)的需求,缩短了手术时间,并显著改善了患者的长期功能预后(减少了护理和康复费用),最终实现了总体成本的节约。在美国,每位患者的一年期总成本可节省约6,297美元;在英国和加拿大也有类似的节省趋势。
6.2 经桡动脉入路(Transradial Access, TRA)的适配
随着心脏介入向经桡动脉入路转移,神经介入也在跟随这一趋势(TRA可以减少穿刺点并发症,提高患者舒适度)。
• 挑战: 桡动脉较细,通常只能容纳6F或7F鞘。现有的8F/9F BGC对于大多数患者的桡动脉来说过粗。 • 创新方向: 研发专用的桡动脉BGC(6F/7F外径,但保持高内径)是当前的热点。例如,日本有研究尝试使用Sheathless(无鞘)技术置入8F Optimo BGC,但这存在导致桡动脉闭塞(RAO)的风险。未来的BGC需要更低的剖面设计(Low Profile)来适应TRA浪潮。
6.3 机器人辅助与集成化
随着血管内介入机器人(如Siemens Corindus)的发展,BGC的稳定性成为了机器人操作的理想平台。机器人系统需要一个稳固的“基站”来精确操控微导管,BGC充盈后提供的锚定作用正好满足这一需求。此外,像Cerenovus这样的大厂正在推动“整体解决方案”,将BGC与取栓支架、抽吸导管打包集成,通过单一供应商生态系统来优化器械间的配合,这可能会成为未来的商业主流。
结语
球囊导引导管(BGC)已经从一个辅助性的可选项,进化为现代急性缺血性卒中治疗的基石。物理学原理和临床数据双重证实:**“近端阻断 + 血流逆转”**是目前减少远端栓塞、提高首过再通率最可靠的机制。
尽管PROTECT-MT试验揭示了其在特定人群(ICAD)和特定条件下的局限性,且“超大内腔”抽吸导管的兴起对其统治地位发起了挑战,但BGC的核心价值——对术中不可控因素(如碎栓)的主动控制——依然无法被完全替代。未来的发展将集中在进一步扩大内径以兼容超级抽吸、优化外径以适应经桡动脉入路,以及与机器人系统的深度融合。对于追求极致安全与效率的神经介入医师而言,BGC在相当长的一段时间内仍将是不可或缺的“定海神针”。


