
L-高苯丙氨酸(L-HPA),为L-苯丙氨酸的同系物,其化学名称为(S)-2-amino-4-phenylbutanoic acid,是一种具有较高商业价值的非天然 α-氨基酸 。作为合成血管紧张素转化酶抑制剂类药物如依那普利(Enalapril)、雷米普利(Ramipril)、赖诺普利(Lisinopril),以及喹那普利(Quinapril)等的核心手性中间体,L-HPA 的需求量随着全球高血压及充血性心力衰竭发病率的上升而逐年增加。除了在抗高血压药物中的应用,L-HPA 还是新型蛋白酶体抑制剂卡非佐米(Carfilzomib)的合成关键片段,该药物在治疗多发性骨髓瘤方面表现出显著疗效 。
Jiuzhou News
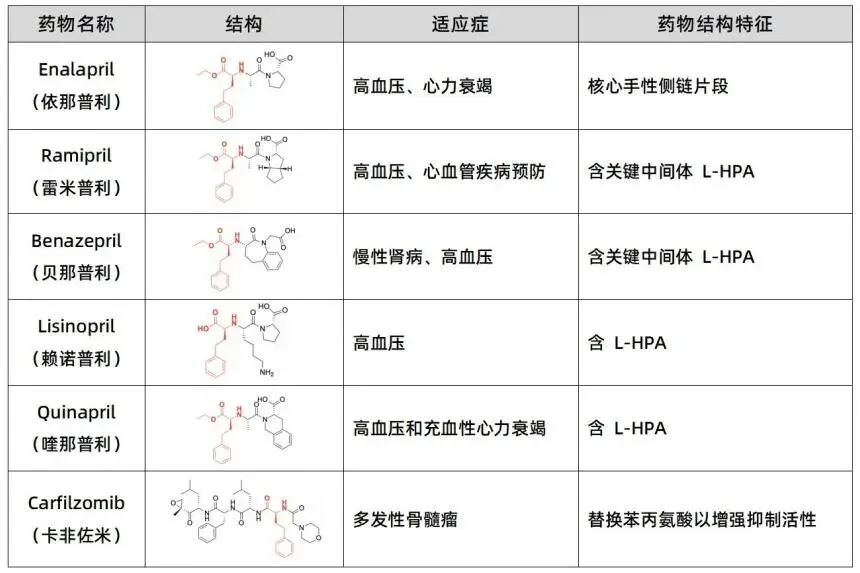
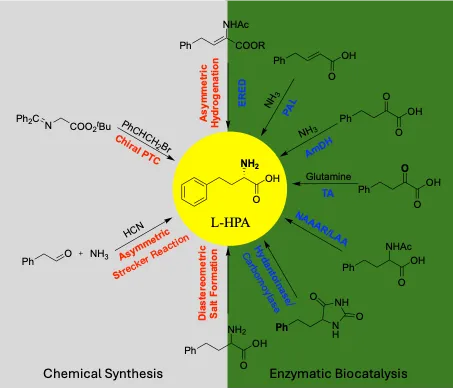
传统的 L-HPA 合成工艺主要依赖于化学法,包括 Strecker 反应、不对称氢化以及化学拆分法。然而,化学合成路径通常涉及多步反应,步骤繁琐且总产率较低,同时还面临着昂贵的手性催化剂、严苛的反应条件以及重金属残留带来的环境污染和后续纯化难题。相比之下,生物催化法凭借其卓越的立体选择性、温和的反应条件以及良好的环境相容性,已成为 L-HPA 大生产领域的研究重心和主流趋势。目前,工业界已开发出多种酶法合成路径,包括海因酶法、脱氢酶法、氨基转移酶法以及新兴的多酶级联催化技术。
酶法动力学拆分(KR)
动力学拆分是制备对映体纯化合物最经典的方法之一,其核心在于利用手性酶对底物中R-异构体和S-异构体具有不同的反应速率常数(kR和 kS)。在L-HPA的合成中,通常通过对乙酰化衍生物或酯类底物的立体选择性水解来实现拆分。
工业级蛋白酶(如Alcalase或Subtilisin)在水相或有机相中表现出优异的选择性。例如,使用工业酶Alcalase对N-乙酰基-高苯丙氨酸乙酯进行水解,可以获得手性纯度高达 98% ee 的L-高苯丙氨酸盐酸盐。这种策略的优势在于工艺流程简单、经济成本低,且使用的酶源广泛。1
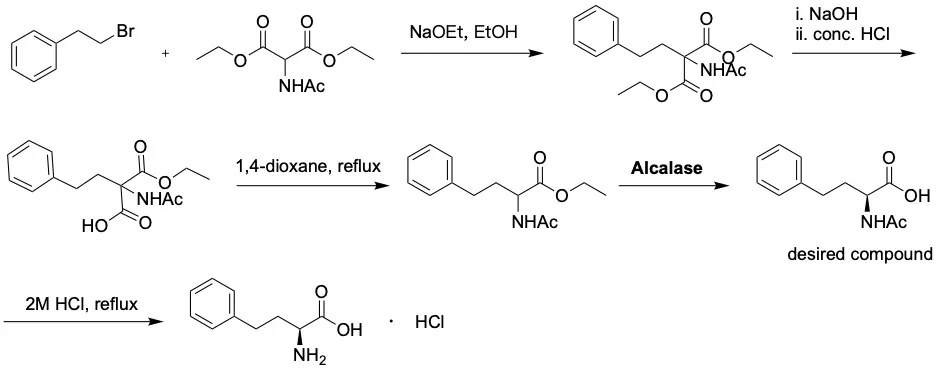
另一种重要的酶类是L-氨基酰化酶(LAA)。LAA能够识别N-酰基-L-高苯丙氨酸并催化其脱酰基反应,生成L-HPA,而D-对映体则保持原样不被转化。由于LAA对L-构型具有极强的专一性,这种方法常被用于从外消旋混合物中提取单一手性异构体。当单独使用 LAA 处理外消旋的 N-乙酰-DL-高苯丙氨酸时,由于酶对 L-构型的高度专一性,仅有一半的底物(L-型)被转化为 L-HPA,理论最高收率为 50%。
酶法动态动力学拆分(DKR)
尽管KR技术已在许多制药工艺中落地,但其本质缺陷限制了其更广泛的应用。由于酶仅能转化一半的对映体,KR过程的理论最高收率被限制在 50%。对于高价值的L-HPA而言,剩余的 50% D-型异构体通常需要经过额外的化学步骤进行回收消旋化,再重新进入拆分循环。这种多步骤的操作不仅增加了设备投入,也显著提高了废弃物产量和整体生产成本。正是基于对“原子经济性”的追求,制药工业界开始将目光投向能够实现 100% 理论转化率的动态动力学拆分技术。
DKR是通过两种或多种酶的级联反应实现的。
海因酶法(Hydantoinase Process)是工业化大规模生产手性氨基酸(包括L-高苯丙氨酸)最成熟且高效的生物催化技术之一。与传统的动力学拆分(KR)相比,该方法通过多酶级联系统实现了对底物的100%理论转化。
海因酶法以5-苯乙基海因(5-PEH)为起始底物(可通过苯丙醛、氰化钾和碳酸铵的Bucherer Berg 反应),主要涉及三种核心酶的协同作用:海因酶(L-Hydantoinase,负责催化L-苯乙基海因环的C-N键水解开环)、海因消旋酶(Hydantoin Racemase,负责实现“动态”消旋化)以及L-氨甲酰水解酶(L-Carbamoylase,负责将中间体N-氨甲酰-L-高苯丙氨酸水解成产品)。
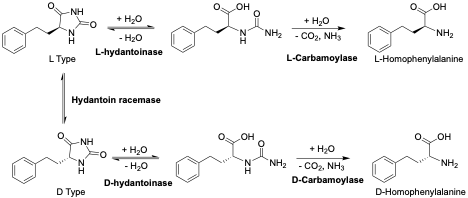
海因酶法通过将化学合成的低成本前体与高效的生物催化闭环相结合,已成为L-高苯丙氨酸及其他医药手性中间体生产生产中成熟且广泛应用的工艺路线之一。
利用N-酰基氨基酸消旋酶(NAAAR)与L-氨基酰化酶(LAA)的组合,也可以实现从N-乙酰基-DL-高苯丙氨酸直接向L-HPA的转化。
赢创(Evonik)及其前身德固赛(Degussa)利用N-酰基氨基酸消旋酶(NAAAR)(来自 Amycolatopsis orientalis)结合LAA成功建立了 DKR 生产线。2 该工艺解决了底物抑制和对重金属离子的依赖问题,大幅度降低了制药中间体的生产成本。
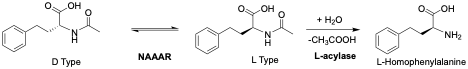
研究者从 Deinococcus radiodurans 中克隆了NAAAR和 LAA 基因,并在大肠杆菌中实现共表达。3 利用这样的高效全细胞催化系统,通过精确调节两酶的活力比例(如固定在 3600 U/L),可以在 1小时内实现 99.9% 的产量,且催化剂可重复利用 6 次以上,转化率依然保持在 96% 以上。
除了拆分路线,直接从前手性前体合成L-HPA也是一种高效的策略,尤其是在转氨酶(Transaminase)和氨脱氢酶(AmDH)的应用上。
转氨酶(Transaminase, TA)法
转氨酶法以2-氧代-4-苯基丁酸(2-OPBA)为原料,通常选用 L-谷氨酸(L-Glu)、L-谷氨酰胺(L-Gln)或 L-天冬氨酸(L-Asp)或L-赖氨酸(L-Lys)为氨基供体,利用磷酸吡哆醛(PLP)依赖的转氨酶,催化氨基从“氨基供体”转移至“氨基受体”前手性酮酸。该方法能够直接从非手性底物构建手性中心,产物光学纯度通常可达 99% ee,无需后续拆分。
转氨酶通过“乒乓机制”工作包含两个阶段。在第一阶段,酶捕获供体氨基酸的氨基生成 PMP(磷酸吡哆胺)中间体并释放酮酸副产物;在第二阶段,PMP 将氨基转移给 2-OPBA,生成具有特定手性的 L-HPA,同时恢复 PLP 辅因子。
转氨酶反应是可逆的,且其平衡常数通常不利于产物生成。此外,高浓度的底物 2-OPBA 往往会产生抑制作用。
通过原位产物移除(ISPR)和副产物级联消除等技术,实现了转氨酶法的L-HPA的工业级规模化生产。4-6
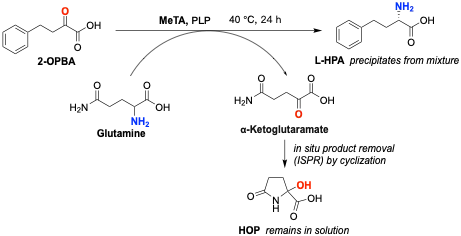
反应过程涉及来源于 Megaphaera elsdenii 的转氨酶(MeTA)催化 2-OPBA转化为 L-HPA,其难溶于反应液中会不断析出,从而打破反应平衡。同时作为氨基供体的谷氨酰胺脱氨生成的 α-酮谷氨酰胺,其可自发环化为 2-羟基-5-氧代脯氨酸(HOP),也促进了产物的不断转化。
氨脱氢酶(Amine dehydrogenase,AmDH)法
氨脱氢酶(AmDH)通过还原氨化(Reductive Amination) 反应,将相应的酮酸底物直接转化为目标氨基酸。AmDH 法L-HPA的合成则是以2-OPBA为原料,以氯化铵或氨水为碳源,以辅酶NADPH(通常用NADP+加GDH为还原系统)为氢供体。通过对天然的谷氨酸脱氢酶(GDH)或 亮氨酸脱氢酶(LeuDH) 或苯丙氨酸脱氢酶(PheDH)进行蛋白质工程改造(如定点突变),使其改变底物特异性,从而能够高效识别 2-OPBA 并将其转化为 L-HPA。

江南大学聂尧团队通过三突变体 V309G/L306V/V144G进化,对来源于巴迪斯芽孢杆菌(Bacillus badius)的PheDH进行了改造,获得的酶其催化效率比野生型高 12.9 倍。7
该方法在210 min 内将 1.08 mol/L 的 2-OPBA 转化为 L-HPA,产量为 174 g/L,转化率为 90.2%。
江南大学刘立明团队报道了一条以苯甲醛和丙酮酸盐为原料、四酶级联催化的高效的L-HPA合成工艺。8
整个工艺包含四个关键步骤:醛缩酶催化的苯甲醛和丙酮酸缩合反应、自发脱水反应、烯还原酶催化的还原反应、经工程化改造的苯丙氨酸脱氢酶(TiPheDH)催化的2-OPBA转化反应。

该工艺在 5 L 反应器中获得了反应浓度为 100.9 g/L ,ee>99%的 L-HPA,转化率为 94%。该方案显著降低了原料成本,被认为是实现L-HPA绿色规模化制造的最具竞争力的路径之一。
总结与未来展望
L-高苯丙氨酸的工业化生产方案已从简单的单酶拆分进化到了高效的多酶级联和全细胞催化阶段。而以苯甲醛为原料的级联酶法方案,通过精妙的代谢工程设计,实现了从基础化工品到复杂手性药物中间体的“一跳式”转化,展现了未来生物制造的巨大潜力。未来的L-高苯丙氨酸的大生产工艺研究重点将集中在以下几个方向:
(1)更低成本的原料路径:进一步优化从葡萄糖、木糖等生物质原料直接发酵生产 L-HPA 的工程菌株,彻底摆脱对苯环类前体化学合成的依赖;
(2)连续流生物催化:结合微通道反应器和高性能固定化酶技术,实现 L-HPA 的连续、自动化生产,进一步提高生产强度和批次稳定性;
(3)耐受性进化:利用合成生物学手段提高菌株对高浓度底物和产物的耐受性,从而将发酵/催化终浓度推向更高水平(如 > 200 g/L)。

参考资料
Zhao, H.; Luo, R.; Wei, D.; Malhotra, S. Concise synthesis and enzymatic resolution of L-(+)-homophenylalanine hydrochloride. Enantiomer 2002, 7 (1), 1–3. DOI: 10.1080/10242430210706.
May, O.; Verseck, S.; Bommarius, A.; Drauz, K. Development of Dynamic Kinetic Resolution Processes for Biocatalytic Production of Natural and Nonnatural l-Amino Acids. Organic Process Research & Development 2002, 6 (4), 452–457. DOI: 10.1021/op020009g.
Hsu, S.; Lo, H.; Kao, C.; Lee, D.; Hsu, W. Enantioselective synthesis of L-homophenylalanine by whole cells of recombinant Escherichia coli expressing L-aminoacylase and N-acylamino acid racemase genes from Deinococcus radiodurans BCRC12827. Biotechnology Progress 2006, 22 (6), 1578–1584. DOI: 10.1021/bp0601241.
Cho, B.; Seo, J.; Kang, T.; Kim, B. Asymmetric synthesis of L-homophenylalanine by equilibrium-shift using recombinant aromatic L-amino acid transaminase. Biotechnology and Bioengineering 2003, 83 (2), 226–234. DOI: 10.1002/bit.10661.
Tiedemann, S.; Stang, A.; Last, S.; Gefflaut, T.; von Langermann, J. Preparative Coupled Enzymatic Synthesis of L-Homophenylalanine and 2-Hydroxy-5-oxoproline with Direct In Situ Product Crystallization and Cyclization. ACS Omega 2025, 10 (14), 14382–14389. DOI: 10.1021/acsomega.5c00590.
Dunham, N. P.; Winston, M. S.; Ray, R.; Eberle, C. M.; Newman, J. A.; Gao, Q.; Cao, Y.; Barrientos, R. C.; Ji, Y.; Reibarkh, M. Y.; et al. Transaminase-Catalyzed Synthesis of β-Branched Noncanonical Amino Acids Driven by a Lysine Amine Donor. Journal of the American Chemical Society 2024, 146 (23), 16306–16313. DOI: 10.1021/jacs.4c05175.
Wu, T.; Mu, X.; Xue, Y.; Xu, Y.; Nie, Y. Structure-guided steric hindrance engineering of Bacillus badius phenylalanine dehydrogenase for efficient l-homophenylalanine synthesis. Biotechnology for Biofuels 2021, 14 (1), 207. DOI: 10.1186/s13068-021-02055-0.
Gao, D.; Song, W.; Wu, J.; Guo, L.; Gao, C.; Liu, J.; Chen, X.; Liu, L. Efficient Production of L-Homophenylalanine by Enzymatic-Chemical Cascade Catalysis. Angewandte Chemie-International Edition 2022, 61 (36). DOI: 10.1002/anie.202207077.
免责声明
本公众号注明原创的内容权利均属九洲药业所有,未经授权,不得擅自使用或许可他人使用。如需获得授权,请和九洲药业提前联系。已获得授权的,应在授权范围内使用,并注明来源且不得再全部或部分转授权他人。
本公众号对转载、分享的内容、陈述、观点判断保持中立,不对所包含内容的合法性、准确性、可靠性或完善性提供任何明示或暗示的保证,该等内容版权归原作者所有,仅供学习参考之用,若对转载、分享的内容有任何权利疑问,烦请联系九洲药业。



