多肽长效药物侧链技术研究报告
多肽修饰种类繁多,从修饰位点不同则可分为N端修饰、C端修饰、侧链修饰、氨基酸修饰、骨架修饰等。作为一种改变肽链主链结构或侧链基团的重要手段,多肽修饰可有效改变肽类化合物的理化性质、增加水溶性、改变其生物分布状况、延长体内作用时间、降低毒副作用、消除免疫原性等。侧链修饰是最常用的长效修饰方法。多肽复杂侧链修饰是指对多肽分子中氨基酸侧链的功能基团进行选择性化学改造,以调控其物理化学性质、生物活性或功能特性。这一策略在多肽药物开发、分子探针设计及功能材料构建中至关重要,尤其适用于天然多肽存在稳定性差、半衰期短或靶向性不足等局限时。多肽长效化侧链通过延缓药物代谢与排泄,显著延长血浆半衰期。例如,脂肪酸侧链可促进药物与血清白蛋白结合,形成“储库效应”,使药物释放周期从数小时延长至数周。聚乙二醇(PEG)侧链通过增大分子量减少肾小球滤过率,同时形成空间位阻降低酶解速率。侧链修饰可抑制多肽分子构象变化:多肽侧链修饰通过引入化学基团改变侧链性质,从而抑制构象变化,增强结构稳定性。其机理主要涉及空间位阻效应、稳定关键相互作用和引入共价约束。空间位阻效应:修饰基团(如聚乙二醇或脂肪酸链)引入后占据空间,阻碍主链旋转或侧链摆动,限制构象自由度,例如脂肽修饰通过疏水链增强分子内相互作用减少无序波动。 稳定氢键网络或疏水核心:修饰如磷酸酯或糖基化可优化侧链极性,增强分子内氢键或疏水堆积,维持折叠状态,例如糖肽修饰通过水化层稳定二级结构。 形成共价约束:如二硫键或环化修饰,直接连接侧链或末端,固定空间取向,例如侧链-侧链环化通过酰胺键锁定β-折叠或α-螺旋构象。pH响应型侧链:在肿瘤微酸性环境中触发构象变化,实现局部药物释放;抗体片段偶联侧链:利用抗原-抗体结合实现靶向递送(如GLP-1受体激动剂与抗体Fc段融合)。第二章 长效侧链主要类型与技术特性
多肽侧链修饰主要针对特定氨基酸残基的反应性基团,包括:
赖氨酸(Lys)侧链:其ε-氨基是常见修饰位点,可通过酰化反应引入乙酰基、烷基或聚乙二醇链(PEG),以降低等电点、增强抗蛋白酶降解能力或延长半衰期;例如,生物素化可利用NHS-生物素试剂实现靶点捕获,而磺酰化则可能增强与靶蛋白的氢键相互作用。
天冬氨酸(Asp)和谷氨酸(Glu)侧链:羧基可通过酯化或酰胺化调节多肽的亲疏水平衡,如甲酯化可提升脂溶性以促进细胞渗透,而乙醇胺酰胺化则可能改善水溶性。
酪氨酸(Tyr)侧链:酚羟基的修饰包括磷酸化(模拟信号转导中的天然修饰)或碘标记(用于放射性成像)。
半胱氨酸(Cys)侧链:巯基具有高反应活性,常用于二硫键形成或点击化学(如叠氮-炔环加成),以构建环状结构或引入荧光基团。
1.化学修饰类侧链
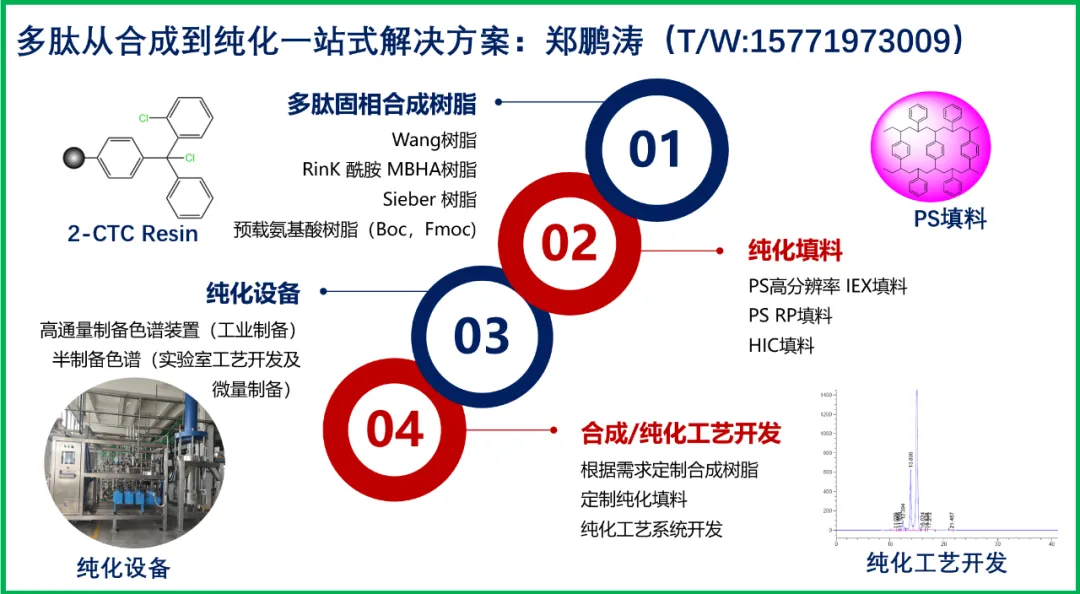
Fc融合蛋白:将多肽与IgG抗体Fc段连接,利用新生儿Fc受体(FcRn)循环机制延长半衰期(如阿必鲁肽);白蛋白结合域:通过基因工程融合白蛋白结合肽(如AlbudAb),使药物-白蛋白复合物半衰期达20-30天。酶切响应链:在特定蛋白酶(如肿瘤微环境MMP-2)作用下释放活性药物,减少全身毒性;ROS敏感链:在炎症部位高活性氧(ROS)环境下断裂,实现精准释药。长期大量供应各种多肽固相合成树脂:如2-CTC树脂,wang树脂,Rink 酰胺树脂 AM(氨甲基树脂),Sieber 树脂等,同时供应各种多肽、重组蛋白、抗体纯化填料,纯化工艺开发。联系:15771973009(微信同)。超长半衰期设计:多肽药物的超长半衰期设计旨在通过多种策略延长其在体内的循环时间,以减少给药频率并提高治疗便利性。核心原理是通过增加分子量、增强稳定性或改变分布特性来减缓肾脏清除和酶解降解。开发双重修饰侧链(如PEG-脂肪酸杂化链),目标将给药间隔延长至3-6个月;其中聚乙二醇化通过将聚乙二醇(PEG)链共价连接到多肽上,显著增大其水动力学体积,从而降低肾小球滤过率并形成空间位阻保护药物免受酶解;例如,长效生长激素和Palopegteriparatid(Yorvipath®)均采用此技术实现每周或更长给药间隔。此外,脂肪酸侧链修饰可引入疏水性基团(如地特胰岛素中的豆蔻酸),使其与血清白蛋白可逆结合,利用白蛋白的长半衰期(约19天)延长多肽滞留时间,但需平衡溶解度与结合亲和力以避免非特异性效应。口服递送突破:口服司美格鲁肽是代表性成功案例,其通过SNAC(N-[8-(2-羟基苯甲酰基)-氨基]辛酸钠)实现高效口服吸收,SNAC的作用机制包括:中和胃酸、保护药物免受胃蛋白酶降解;促进分子解聚(从多聚体转变为单体)以提升渗透性;以及调控膜流动性增强跨细胞转运;临床数据显示口服制剂吸收迅速(约1小时),且通过剂量滴定可实现显著疗效(如HbA1c降低约2%)。通过化学修饰增强多肽的稳定性和渗透性,例如脂肪酸酰化修饰(如司美格鲁肽和利拉鲁肽)在多肽链上引入脂肪酸侧链,使其与白蛋白可逆结合,从而延长半衰期、躲避酶解并增加脂溶性,促进跨膜转运;同时,分子量控制(如使用短链多肽)或结构稳定性提升(如环化)也有助于改善口服生物利用度。通过化学修饰增强多肽的稳定性和渗透性,例如脂肪酸酰化修饰(如司美格鲁肽和利拉鲁肽)在多肽链上引入脂肪酸侧链,使其与白蛋白可逆结合,从而延长半衰期、躲避酶解并增加脂溶性,促进跨膜转运;同时,分子量控制(如使用短链多肽)或结构稳定性提升(如环化)也有助于改善口服生物利用度。AI驱动优化:利用深度学习预测侧链-多肽构效关系,缩短设计周期(从18个月压缩至6个月)。慢性病需求激增:全球糖尿病患者超6亿,肥胖症患者达12亿,推动GLP-1类药物年需求增长23%;专利到期潮:2026-2030年将有17款重磅多肽药物专利到期,催生侧链改良型仿制药市场(预计规模180亿美元);新型适应症拓展:阿尔茨海默病、NASH治疗中多肽药物渗透率提升(2024年相关临床试验增加40%)。规模:全球长效多肽药物市场将突破900亿美元,侧链技术贡献值占比提升至75%;技术分布:智能响应型侧链市场份额将达28%,超越传统PEG修饰(25%);区域格局:中国市场份额从15%增长至30%,成为最大仿制药供应基地。免疫原性控制:PEG侧链引发抗药物抗体(ADA)概率达12%,限制长期使用;PEG侧链作为外来大分子,可能通过T细胞非依赖性(Ti)途径激活B细胞,导致抗PEG IgM的快速产生,这种反应主要由PEG的重复表面抗原通过多价交联B细胞受体(BCR)启动,不依赖T细胞辅助,因此产生的抗体亲和力较低且短暂;然而,部分个体也可能通过T细胞依赖性(Td)途径产生高亲和力IgG类ADA,这涉及抗原呈递细胞摄取PEG后处理并呈递肽-MHC II复合物,激活滤泡辅助T细胞,进而促进B细胞分化为浆细胞和记忆B细胞,导致持久的ADA反应。大规模生产壁垒:固相多肽合成(SPPS)作为工业主流,适用于10-50个氨基酸的合成,但复杂侧链多肽(如含二硫键、环化结构或非天然氨基酸)的合成效率显著降低,副反应(如消旋化、交联)风险增加,且需要多轮重复的缩合、洗涤和去保护操作,自动化难度高;液相合成虽可减少试剂浪费,但载体对氨基酸载量低,不适合中长肽段的大规模生产;生物合成法(如发酵法)依赖宿主细胞表达,但复杂侧链的翻译后修饰(如糖基化或磷酸化)效率低,产物异质性高,难以精确控制。复杂侧链多肽通常需引入支链保护基团(如苄基或叔丁基),这些基团需在合成后期用强酸去除,但保护基的选择与脱保护条件(如酸性或碱性环境)需与侧链官能团兼容,否则易引发副反应;例如,Fmoc策略虽温和适用于多数侧链,但对酸敏感基团(如某些环状肽)可能不适用,而Boc策略则需优化酸性脱保护条件以避免骨架断裂。监管标准升级:FDA要求新型侧链提供10年以上安全性追踪数据,延长上市周期。参考资料:刘梦,于彭城,徐寒梅. 蛋白多肽类药物长效化技术研究进展[J]. 药学进展,2019,43(03):209-216.免责声明:本微信文章中的信息仅供一般参考之用,部分内容摘自网络及AI生成,如有侵权联系删除。此公众号任何时候都不保证文中描述内容的可靠性,不可直接作为决策内容,生物制药合伙人不对任何主体因使用本文内容而导致的任何结果承担责任。公众号已建立“生物药工艺开发技术交流”微信群,添加小编微信514099167 加入,加微信时备注姓名-单位-岗位,非生物制药行业人员勿扰。