
点击蓝字 关注我们,获取更多服务和资讯
2025.12.17~2025.12.31
导语
佐盛资讯,定期整理汇总NMPA、CMDE、NIFDC等各机构的法律法规更新与通告通知。
关注佐盛资讯、订阅合集,轻松掌握医疗产品行业最新动态!帮助大家提高工作、学习效率。
目录
01 |国家药品监督管理局公告通告 |
02 |国家药品监督管理局监管动态 |
03 |器审中心通知公告 |
04 |器审中心共性问题 |
01
国家药品监督管理局公告通告
1
国家药监局关于撤销外周可调弯导引导管医疗器械注册证的公告(2025年第122号)
原文网址:https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20251217091719196.html

2
国家药监局关于发布互联网药品医疗器械信息服务备案管理规定的公告(2025年第123号)
原文网址:
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20251222182516159.html
3
国家药监局关于发布医疗器械出口销售证明管理规定的公告(2025年第126号)
原文网址:
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20251225100838171.html

02
国家药品监督管理局监管动态
1
国家药监局关于批准注册305个医疗器械产品的公告(2025年11月)(2025年第121号)
原文网址:
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxpzhzhcchpgg/20251217154129166.html

03
器审中心通知公告
1
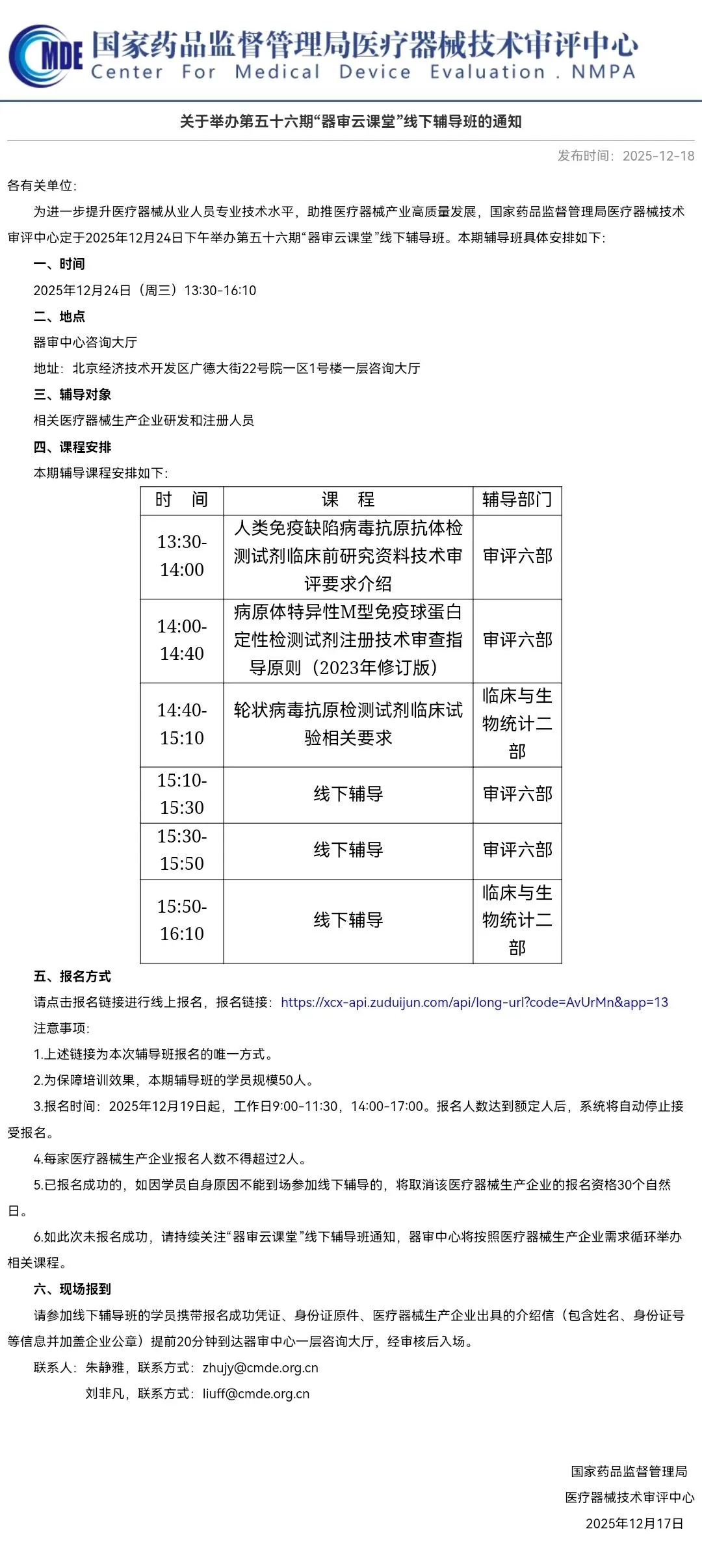
关于举办第五十六期“器审云课堂”线下辅导班的通知
本期课程安排:人类免疫缺陷病毒抗原抗体检测试剂临床前研究资料技术审评要求介绍、病原体特异性M型免疫球蛋白定性检测试剂注册技术审查指导原则(2023年修订版)、轮状病毒抗原检测试剂临床试验相关要求。
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251218144350103.html
2
关于调整医疗器械注册受理前技术问题咨询工作安排的通告(2025年第30号)
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251223104951164.html

3
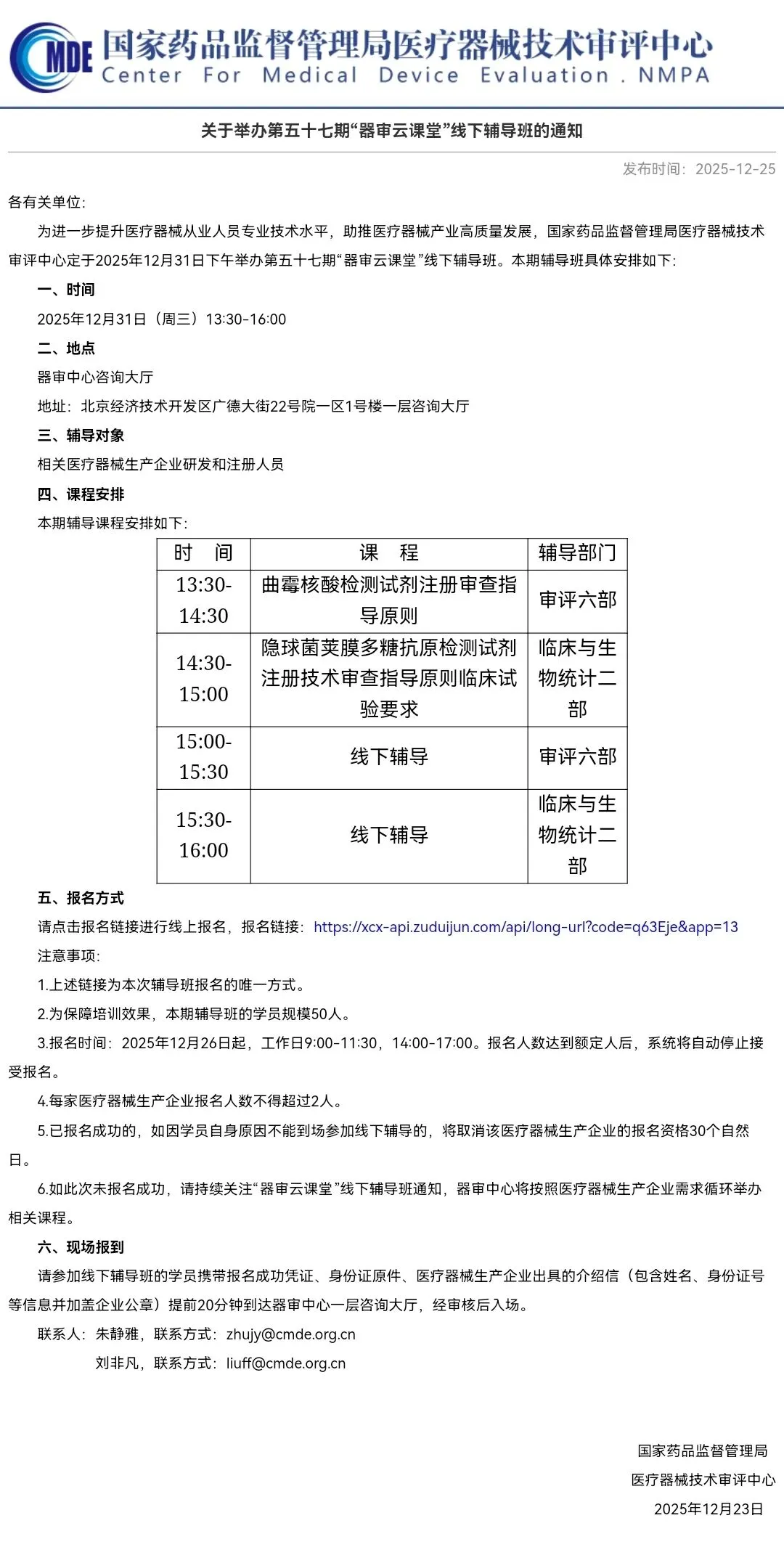
关于举办第五十七期“器审云课堂”线下辅导班的通知
本期课程安排:曲霉核酸检测试剂注册审查指导原则、隐球菌荚膜多糖抗原检测试剂注册技术审查指导原则临床试验要求。
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251225085001195.html
4
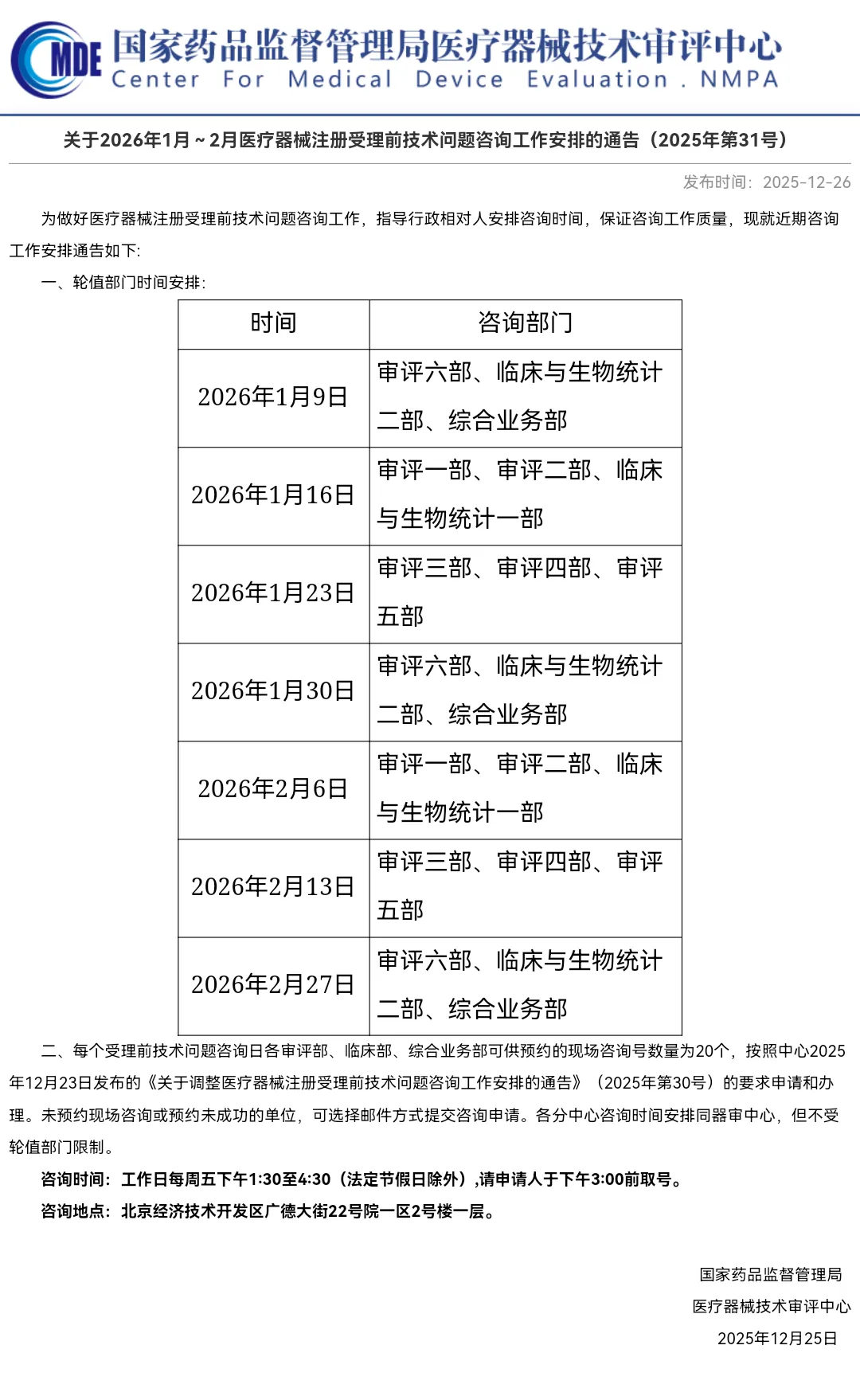
关于2026年1月~2月医疗器械注册受理前技术问题咨询工作安排的通告(2025年第31号)
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251226085100182.html
5
关于公开征求《等离子手术设备审评要点(征求意见稿)》等9项医疗器械技术审评要点意见的通知
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251229164551155.html

6
国家药监局器审中心关于发布体外诊断试剂变更注册审查指导原则等2项注册审查指导原则的通告(2025年第32号)
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251230093528175.html

7
关于公开征求《数字聚合酶链反应分析仪注册审查指导原则(征求意见稿)》意见的通知
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251230111327189.html

8
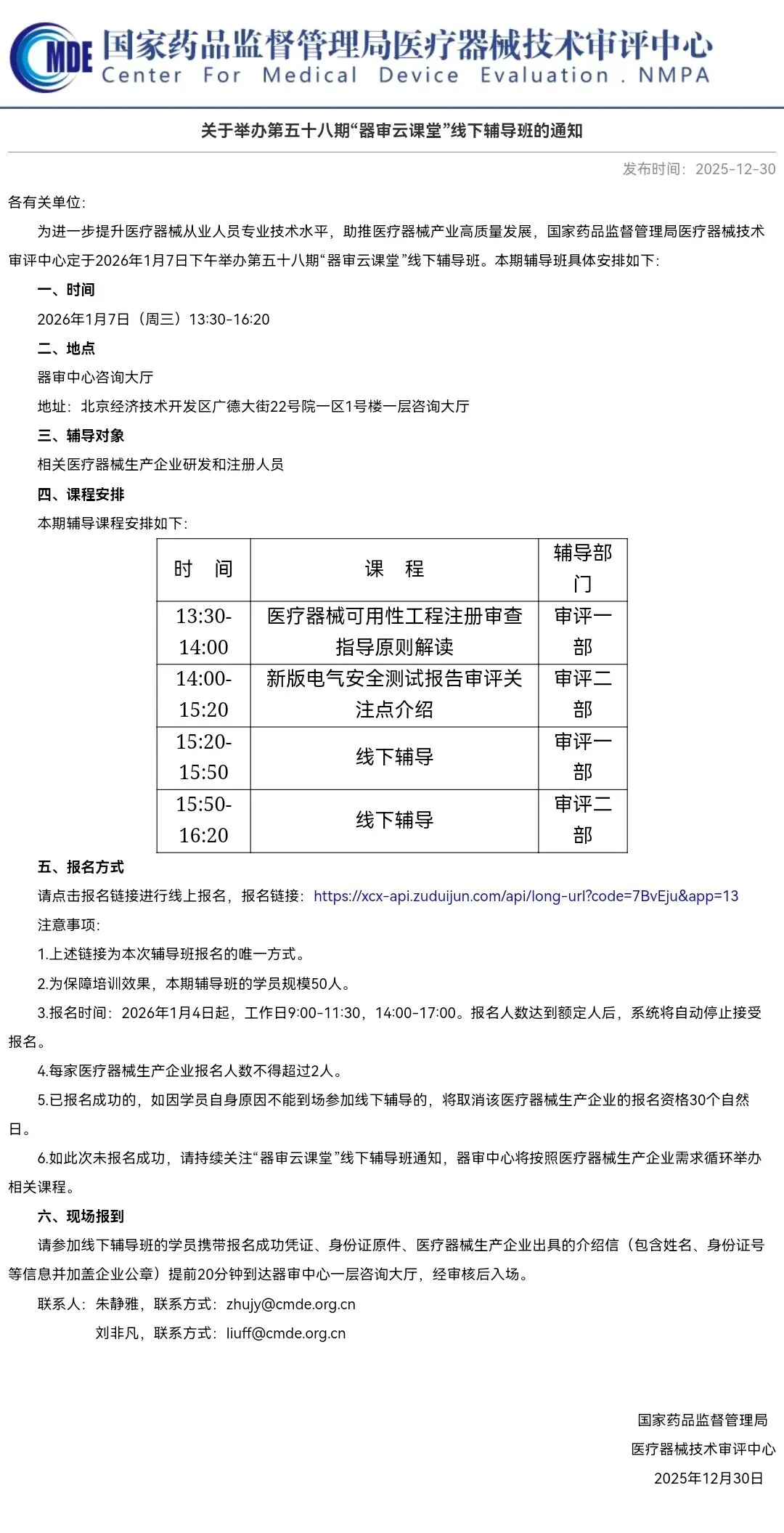
关于举办第五十八期“器审云课堂”线下辅导班的通知
本期课程安排:医疗器械可用性工程注册审查指导原则解读、新版电气安全测试报告审评关注点介绍。
原文网址:
https://www.cmde.org.cn/xwdt/zxyw/20251230162213148.html
04
器审中心共性问题
1
能否使用其他光学设计的人工晶状体货架有效期研究资料部分代替申报产品研究资料?应注意哪些事项
原文网址:
https://www.cmde.org.cn/splt/ltgxwt/20251223133220180.html


【关于我们】
佐盛技术服务,专注于医疗产品领域,为医疗产品领域企业提供注册、临床、体系、工厂建设、产业化技术服务、国际认证一站式服务。我们将秉承“专业、精准、高效”服务原则,竭诚为医疗产品领域企业保驾护航!您刚好有需求,我们正好专业!欢迎洽谈咨询。
END


