[企业名称] 质量管理体系管理评审报告
1. 评审基本信息
项目 | 内容 |
评审编号 | QMS-MR-[年份]-[序号] |
评审主题 | 基于 GB/T 42061-2022 的质量管理体系适宜性、充分性、有效性评审 |
评审周期 | [XXXX 年 XX 月 XX 日]-[XXXX 年 XX 月 XX 日](覆盖数据周期:XXXX 年 XX 月 - XXXX 年 XX 月) |
主持人员 | (最高管理者姓名 + 职务) |
参与人员 | (各部门负责人、管理者代表、质量部核心成员等,列出姓名 + 职务) |
评审形式 | 现场会议□ 线上会议□ 混合会议□ |
评审日期 | XXXX 年 XX 月 XX 日 |
记录人员 | (姓名 + 职务) |
2. 评审目的
- 评估质量管理体系是否持续满足 GB/T 42061-2022 标准及适用法规要求;
- 验证体系是否适配企业战略目标、产品发展及市场变化;
- 识别体系运行薄弱环节,确定改进方向及资源需求;
- 确保体系持续有效运行,保障医疗器械安全与性能。
3. 评审输入资料汇总
输入类别 | 提交部门 | 资料完整性(√/×) | 备注(未提交原因 / 补充说明) |
反馈信息 | 销售部 + 售后部 | ||
投诉处置情况 | 售后部 + 质量部 | ||
向监管机构报告 | 法规部 + 质量部 | ||
审核结果 | 质量部 | ||
过程的监视和测量 | 生产部 + 质量部 | ||
产品的监视和测量 | 质量部 | ||
纠正措施与预防措施 | 质量部 + 各相关部门 | ||
以往管理评审的跟踪措施 | 质量部 | ||
可能影响体系的变更 | 各相关部门 | ||
改进的建议 | 各相关部门 | ||
适用的新的或修订的法规要求 | 法规部 + 质量部 | ||
其他补充资料 | 各相关部门 |
4. 评审核心结论
4.1 体系运行总体评价
- 适宜性:□ 完全适配 □ 基本适配(需局部调整) □ 不适配(需重大调整);
- 充分性:□ 过程覆盖全面 □ 关键过程覆盖完整(次要过程需补充) □ 存在重要过程缺失;
- 有效性:□ 目标达成良好 □ 基本达成(部分指标未达标) □ 未达成(需整改);
- 核心依据:(简要说明,如 “质量目标达成率 92%,内部审核不合格项同比下降 15%,但设计开发转换流程存在短板”)。
4.2 关键问题识别(按重要性排序)
- (问题描述):如 “新修订的《医疗器械生产质量管理规范》部分条款未融入现有体系文件”;
- 影响分析:(如 “可能导致合规风险,影响产品注册延续”);
- 关联输入:(如 “适用的新的或修订的法规要求分析报告”);
- (问题描述):如 “核心零部件采购产品检验合格率连续 3 个月低于目标值 98%”;
- 影响分析:(如 “增加成品不合格风险,影响顾客信任”);
- 关联输入:(如 “采购产品的监视和测量数据、供方绩效评价结果”);
- (依次列出其他关键问题)。
5. 评审输出及改进措施计划
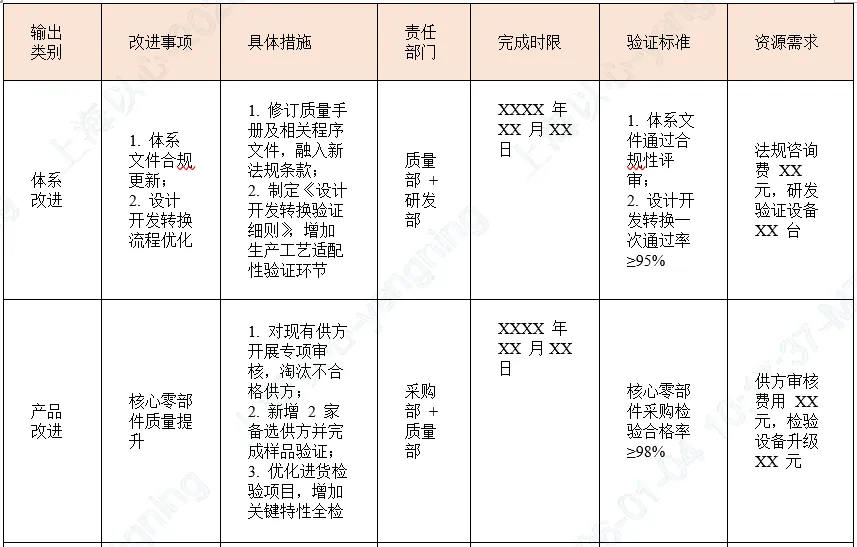
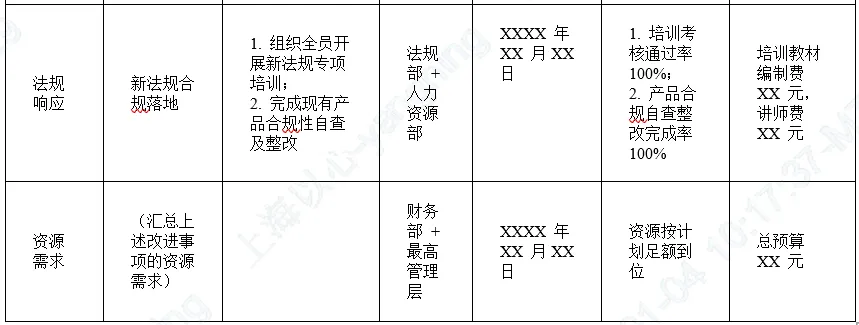
6. 跟踪验证要求
- 责任部门需在完成时限前提交《改进措施落实情况报告》及相关证据材料;
- 质量部每月跟踪进度,形成《改进措施跟踪台账》,向最高管理者汇报;
- 未按计划完成的事项,需提交延期申请及原因分析,重新确定完成时限;
- 所有改进措施的验证结果,将作为下一次管理评审的输入内容。
7. 签字确认
角色 | 姓名 | 职务 | 签字 | 日期 |
主持人员-最高管理者 | ||||
管理者代表 | ||||
质量部负责人 | ||||
(其他参与核心部门负责人) |


