导语:当工地开始"光合作用"——水泥裂缝里开出的蓝藻花"

2025年,在中国生物材料领域,一场由监管逻辑主导的深刻变革正在重组胶原蛋白行业上演。这场变革通过对技术路径的精准甄别,为产业的未来划分了三条泾渭分明的道路:
“极致之路”:
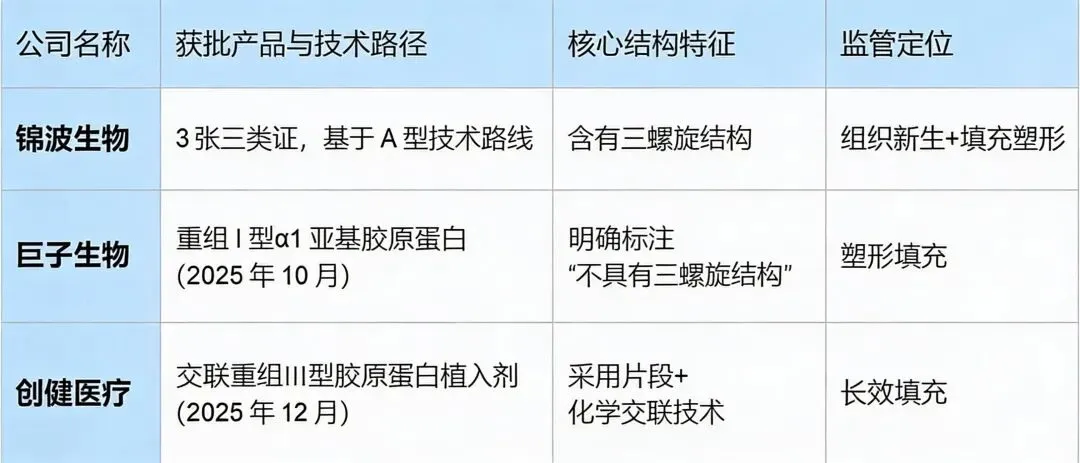
以锦波生物为代表,执着于在分子层面复刻人体胶原的天然“密码”,其公布的“164.88°柔性三螺旋结构”是对结构完整性的极致追求。
“实用之路”:
以巨子生物为代表,其获批产品直白标注“不具有三螺旋结构”,坦率地选择了功能片段化与产业化效率,开辟了一条务实的赛道。
“平衡之路”:
以创健医疗为代表,通过引入外源标签与化学交联技术,在“生物学理想”与“工程学现实”之间搭建桥梁。

这三条路径的并存,折射出一场持续五年的监管变革已从幕后走向台前。行业已从早期命名混沌的“创世纪”,历经结构分型的“启蒙时代”,正式迈入了以高级结构为终极标尺的“理性纪元”。
一、核心逻辑的根本性转变:从“身份界定”到“功能溯源”
监管的焦点已从“是什么”(身份)和“是否安全”(材料安全性),深入至“为何以及如何起效”(功能溯源)的科学本质。
这一转变直接导致了审批路径的清晰分化:
作为“活性材料”:旨在高端再生医学的产品(通常是A型),需提供近乎药品级别的证据链(如明确的作用靶点、量效关系)。
作为“支撑材料”:主要功能为物理填充的产品,其适应症宣称将被严格限定(如只能宣称“改善皱纹外观”),不能模糊暗示“再生”等生物活性词汇。
二、监管政策的演进四阶段(2021-2025年)
1.第一阶段(2021-2022年):命名规范期——为行业建立“身份证”体系
关键政策:2021年《重组胶原蛋白生物材料命名指导原则》发布,确立了重组人胶原蛋白、重组人源化胶原蛋白和重组类胶原蛋白的三级分类体系,终结了命名混乱的时代。
2.第二阶段(2023年):结构分级期——A/B分型重塑技术路线
关键政策:《重组人源化胶原蛋白》(YY/T 1888—2023)行业标准实施,创新性地提出了“A型(无外源序列)和B型(含标签序列)”的分类方法,监管重心转向高级结构特征。
3.第三阶段(2024-2025年):分化发展期——监管与技术路径深度耦合
市场格局定型:截至2025年底,三类证格局明确,技术路径与监管定位紧密挂钩。
三、2026年趋势预判:从“单一指标”到“证据体系”的构建
监管将致力于构建一个多维度、相互印证的证据体系,而非推出单一的“终极标尺”。
1.检测评价体系的精细化与系统化
焦点将转向解决“复杂基质”中的准确测量。即将实施的YY/T 1954-2025《重组胶原蛋白肽图指纹图谱分析》 标准(2026年3月1日),将通过液相色谱-高分辨质谱法进行肽图覆盖率和异质性分析,与高级结构数据共同构成质量评价体系。
2.功能声称与多层级证据的严格匹配
“再生”等级别声称需匹配细胞-动物-临床三级证据链。适应症描述将根据证据体系受严格限制。
3.全生命周期监管成为常态
对于采用新技术(如非天然序列、化学交联)的产品,长期的上市后研究与安全性随访将成为标配,监管贯穿产品整个生命周期。

四、行业终局推演:技术代差将重构市场格局
当前,头部企业研发投入持续加大,同质化竞争导致价格压力,资本市场转向“价值甄别”。
基于此,技术代差将成为决定企业生存的根本因素:
能够提供完整结构证据、构建完整证据链的企业,将获得高端市场的“入场券”。
无法突破技术和证据壁垒的企业,生存空间将持续压缩。
这不仅是监管升级,更是行业价值判断标准的根本性变革。
五、结语:监管的本质是价值的试金石
回顾五年历程,监管问题从“是什么”的身份问题,演进至“为什么有效”的科学问题。
2026年,当行业狂欢褪去,理性的光辉将照亮前路。监管这块最公正的试金石,将检验出真正的价值创造者。那些将结构真实性视为信仰、用扎实的多维度数据证据链构建护城河的企业,才能穿越周期,定义未来。
最后的思考:当监管的探照灯照亮每一个技术细节时,你的企业是拥有被审视的底气,还是只有逃避的惶恐?在结构与效用的天平上,我们最终要回答的不仅是监管的问询,更是对生命科学的根本尊重。

(作者系长期从事生物医药转化。本文基于公开政策文件、行业研究报告及作者专业观察,仅代表个人观点,不构成任何投资或决策建议,亦非对任何特定企业或产品的评价。)

别忘了点赞 +推荐
+推荐 哦!
哦!


