有机合成工艺优化--3.3放大反应中有用试剂
前面简述了试剂选择的目的、原则、放大反应用理想试剂特点(详见3.1),下面讲述如何从理想试剂中选择有用试剂应用于放大反应,
本节将举例讨论了经常大规模使用的试剂系列。这些试剂和事例说明了前面刚刚讨论过的一些原则。读者可能会发现这些例子很有用,这些经验或者可以直接应用到自己的工作中,或者由此产生一些新的想法而应用到其他方面。
II.A去质子化试剂
在学术界,正丁基锂和氢化钠通常用于从弱酸性分子脱质子并允许进一步的 反应。然而在放大反应上,这些试剂很少选择,因为它们非常容易着火。另外它们的副产品,丁烷和氢气也为易燃的化合物,作为气体排放必须考虑其安全性。正丁基锂和氢化钠的许多替代品列于表3. 5,作为比较,其中包括正丁基锂。

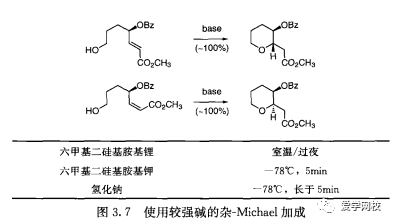
表3.5中的试剂优于正丁基锂和氢化钠通常基于安全理由。例如,正已基锂和正辛基锂不易着火,可以在室温储存。这些试剂的副产品比较容易回收,更有生态效率(图3. 5)。六甲基二硅烷胺的碱金属盐是强度适中的碱,不会产生氢气副产物,在后处理过程中遇水产生的六甲基硅醚(沸点101C)是一-种容易回收的副产品。图3. 6显示了六甲基二硅基胺基钠在制备PDE IV抑制剂时反应形成中间体3的反应[2],以及六甲基二硅基胺基锂形成克里希丸中间体4的反应。碱性的强弱依赖于该碱的碱金属部分的性质,如图3. 7所示的杂Michael加成[41。人们忽视了相转移催化的反应(PTC)0), 实际上使用相转移催化剂能提供安全、经济的替代强碱的反应(见图2. 18)。
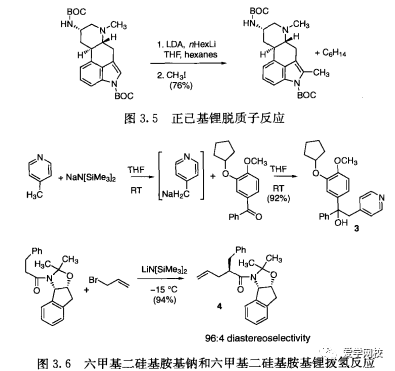
注意:氨基锂、钠拔甲基氢、羰基和吲哚邻位氢
总结:
01.小试时:正丁基锂和氢化钠用于弱酸脱质子,但易着火,副产品也易燃,不可用于放大反应。放大反应:替代品不易着火,副产品易回收。
02.使用相转移催化剂能提供安全、经济的替代强碱的反应
III.B醇碱
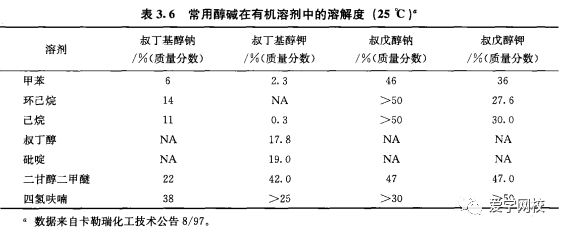
叔丁基醇钾在学术界经常作为中等强度的碱使用。在放大反应上,因为其在有机溶剂中相对较低的溶解度妨碍了它的广泛使用。叔戊醇的醇碱有较好的溶解度(表3. 6),应考虑在放大反应上取代叔丁基醇钾,而且叔戊醇钠和叔戊醇钾都比较易得。
III.C胺碱
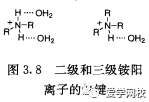
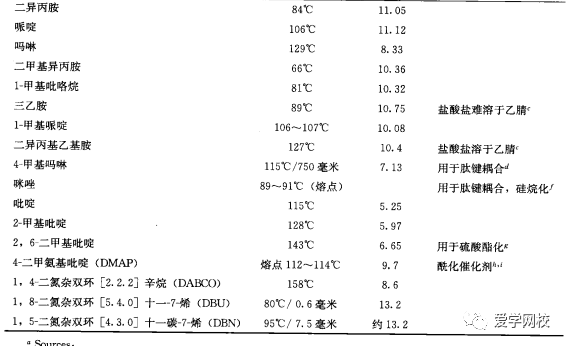
在学术界,三乙胺最常被用于清除反应过程中产生的酸。三乙胺常用于放大反应,但是,在某些情况下,还有许多其他胺表现出不同的优势。表3.7显示了放大反应上常用的廉价的碱,并以伯胺、仲胺、叔胺分类。值得一提的是在水中仲胺比类似的叔胺碱性更强。这可能是质子化后的仲胺的氢与水由于氢键结合稳定性增加的缘故(图3.8)[16]在不能产生氢键的溶剂中,其碱性并与取代胺的诱导效应一致:在对氯苯中的碱性强弱顺序是BuNH2< Bu2NH < < Bu3N[17].
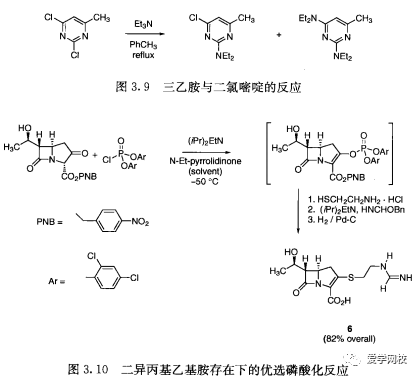
叔胺和吡啶的亲核性是其优势所在,但也可能引起问题。4-二甲氨基吡啶(DMAP)常被用作酰化催化剂[18]。在放大反应上,催化剂量的吡啶有时可能会取代较昂贵的DMAP。比2-甲基吡啶和吡啶碱性稍强的是2,6-二甲基吡啶,因为两个甲基的空间位阻使得其活性降低[19]DABCO.上的氮原子碱性特别强,因为烷基取代基的双环性环暴露了氮原子上的自由电子对。DABCO是Baylis Hillman反应的一个组分(见图4.15 (d))。三乙胺可以作为.亲核反应,如图3.gc2],这种反应可以带来意想不到的问题。在亚胺培南的制备反应里(6,图3.10),位阻更大的二异丙基乙基胺(Hunig's base)比同类的三乙胺更好,因为二异丙基乙基胺比三乙胺更不易与磷酸化试剂反应[21]。
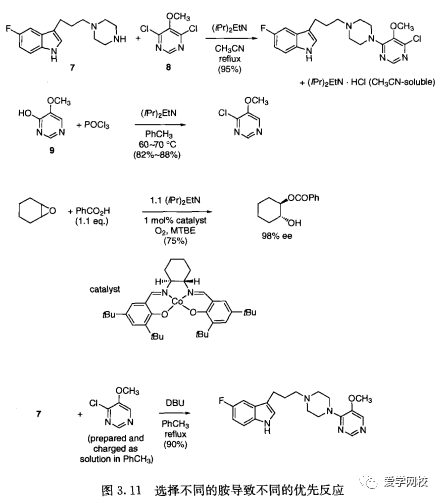
胺与酸生成的盐的溶解度(表3.7)可以为规模化生产提供一些方便操作的有利信息。二异丙基乙基胺使得取代哌啶7和二二氯嘧啶8在乙腈中发生缩合反应的后处理非常容易(图3.11):在偶联反应后,二异丙基乙基胺-盐酸盐副产品溶解在反应溶液里,而产品在此条件下可以结晶分离出来[2]。如果用三乙胺取代二异丙基乙基胺,则因为三乙胺盐酸盐不溶于乙腈,而使产品受污染。


二异丙基乙基胺9在羟基嘧啶氯化反应中也优于三乙胺(图3.11),因为在三乙胺的存在下氯化反应不完全[22]。二异丙基乙基胺使环氧环己烷与苯甲酸开环反应的收率增加,反应速率和手性选择性也得到提高:因为二异丙基乙基胺使得苯甲酸在甲基叔丁基醚溶剂里具有良好的溶解性([23]。用DBU作碱使化合物7溶解在甲苯中,并在60~70C快速反应(图3. 11),用其他碱由于形成非匀相条件不会有如此好的反应效果[22]5-氟吲哚7(pKa值约16.3)和DBU(pKb值13.2)形成的盐可能影响了反应物的溶解性,在这种情况下,不仅仅是亲脂性的缘故,同时也因为正丁胺无助于均相溶液的形成。.上述例子均说明研究胺的替代物的重要性。
总结:
III. D氧化
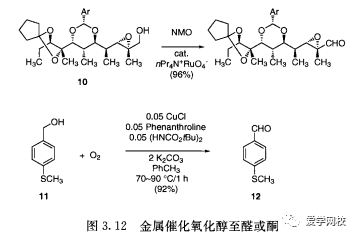
氧化是放大反应上最麻烦的反应之一,这是由于所用试剂的毒性和危险性,处理含重金属如铬试剂的高费用,以及费力的后处理过程。近年来,关于氧化的工作已经有了很大改善,尤其是大量使用催化试剂作为主要的氧化剂。这方面的一个例子是钌催化氧化伯醇10(图3.12),N-甲基吗啉N-氧化物是主要的氧化剂[24]。Marko的研究小组表明,氧气和铜催化剂可用于苄醇到醛的氧化过程,甚至在芳硫醚存在的情况下(图3.12)[25]以上每一种反应且都有良好的收率。
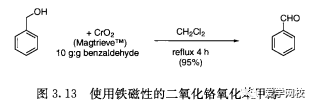
一种用于制造磁带的铁磁性的二氧化铬很有可能成为三氧化铬参与的氧化反应的替代物[26]。反应时采用过量的二氧化铬,被还原的铬(III)附着在催化剂晶体表面。苄醇的氧化反应中用磁铁在瓶外吸住催化剂,氧化后的反应液就可以倾倒出来,苄醇的氧化收率很高(图3.13),并且在产品中测量的铬含量小于12ppm。在放大反应上,金属盐也许可以通过磁化的过滤器从产品的反应液分开。低成本和在产品中的低金属盐污染使这个试剂成为很有前途的化学氧化剂之一。
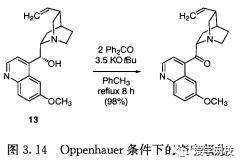
Oppenhauer氧化也完全可以用更方便的试剂取代传统上使用的氧化剂,用二苯甲酮和叔丁醇钾氧化奎宁13 可以得到不错的收率(图3. 14),其他氧化剂就没如此高效[2]。这个反应可以被看作是Oppenhauer氧化或Meerwein Pondorf-Verley还原,这取决于人们将氧化反应还是还原反应看作为主反应。镁催化的Meerwein Pondorf- Ver-ley还原被证明是在格氏反应中形成大量杂质的主要反应2[8]。
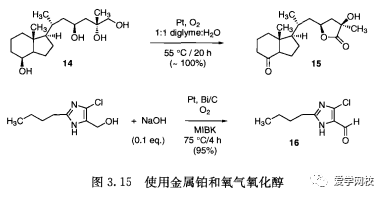
在某些情况下,伯醇可以被铂和氧气氧化为醛或内酯。四醇14被选择性地脱氢到内酯15。在这种情况下(图3.15),少量的十二烷基硫酸钠(SDS) 对达到良好的转换率是必要的[29]。类似的氧化是用来制备洛沙坦前体16 (图3. 15)[90]
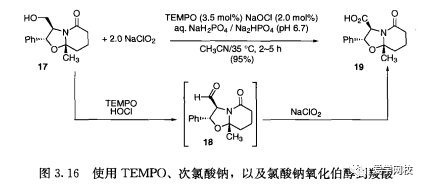
伯醇可以有效地氧化成羧酸而无需使用金属催化剂,如图3.16所示[1]。用催化剂量2,2, 6, 6, -四甲基哌啶氮氧化物(TEMPO)、催化剂量的次氯酸钠、当量的氧化剂氯酸钠氧化伯醇17可以通过中间体醛18高收率的得到化合物19 (参见图9.10)。
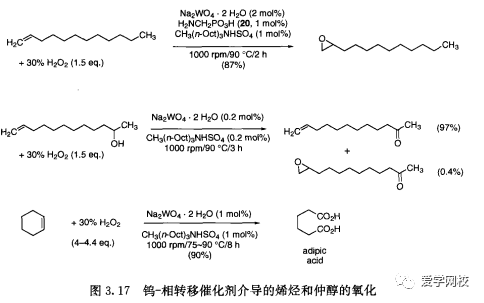
Noyori研究小组已经开发出用30%过氧化氢在无溶剂的条件下,使用钨催化氧化的反应(图3.17)。这项工作的关键是使用无氯的相转移催化剂(PTC) 条件:氯化钠阻碍了在氨甲基膦酸20存在下的环氧化反应[38]。当不加20的情况下,即使有烯烃存在,仲醇被选择性地氧化成酮1[33]。仅使用稍多于四个当量的过氧化氢,环已烯就可被氧化为己二酸43[41]。这个钨催化反应的收率很好,工业应用的可能性非常高。
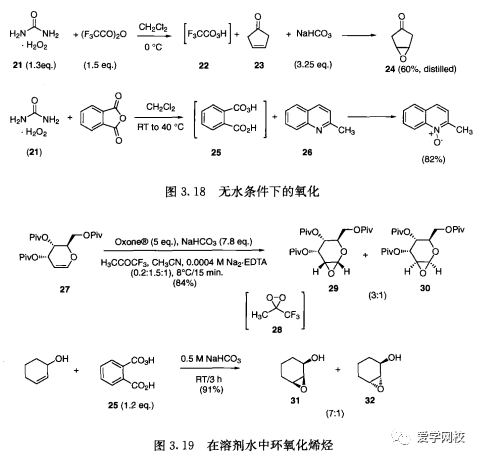
尿素-过氧化氢(“过氧氨基甲酸酯”21)现已被用来作为无水过氧化氢的来源(图3.18),21和三氟乙酸酐反应生成三氟过氧乙酸22,加人不饱和酮23生成蒸馏收率达60%的环氧化物24[35]。用邻苯二甲酸酐处理18产生单过氧邻苯二甲酸(MPPA,25),可以用来氧化喹啉26[36]。这些实用的反应条件可以取代间氯过氧苯甲酸(mCPBA),因为市面上已经不生产高纯度的mCPBA,并开始在某些地区限制使用,一些水溶性环氧化试剂在烯烃环氧化方面可以替代mCPBA (图3. 19)。三氟丙酮和过硫酸氢钾在乙腈水溶液中反应产生的双环氧乙烷28,后者可在环氧化烯糖27时达到84%的收率[37]。非对映选择性的环氧化可以使用三氟丙酮以外的其他酮[8]。用25处理环已醇得到主要是顺式的环氧化物31[39]。
单过氧邻苯二甲酸(MPPA)镁可用作在正丁醇-水混合物中环氧化烯烃,后处理时剩余氧化试剂可以被水洗掉[40]
总结:
01.氧化最麻烦:毒性、危险性、后处理
02.金属催化氧化:伯醇成醛
钌催化氧化+吗啉氮氧化物NMO、铜CuCl+氧气、CrO2+CH2Cl2(磁铁回收)
03.有机催化氧化:
3.1伯醇成酮:
二苯甲酮和叔丁醇钾、过氧化氢+钨酸钠(先醇后烯)+PTC(无氯想转移催化剂甲基三辛基硫酸胺)
3.2伯醇成酸
TEMPO+次氯酸钠+氯酸钠
3.3烯烃成环氧
尿素+过氧化氢(过氧氨基甲酸酯)+邻苯二甲酸酐、三氟丙酮和过硫酸氢钾


