
文献解读与研究思路
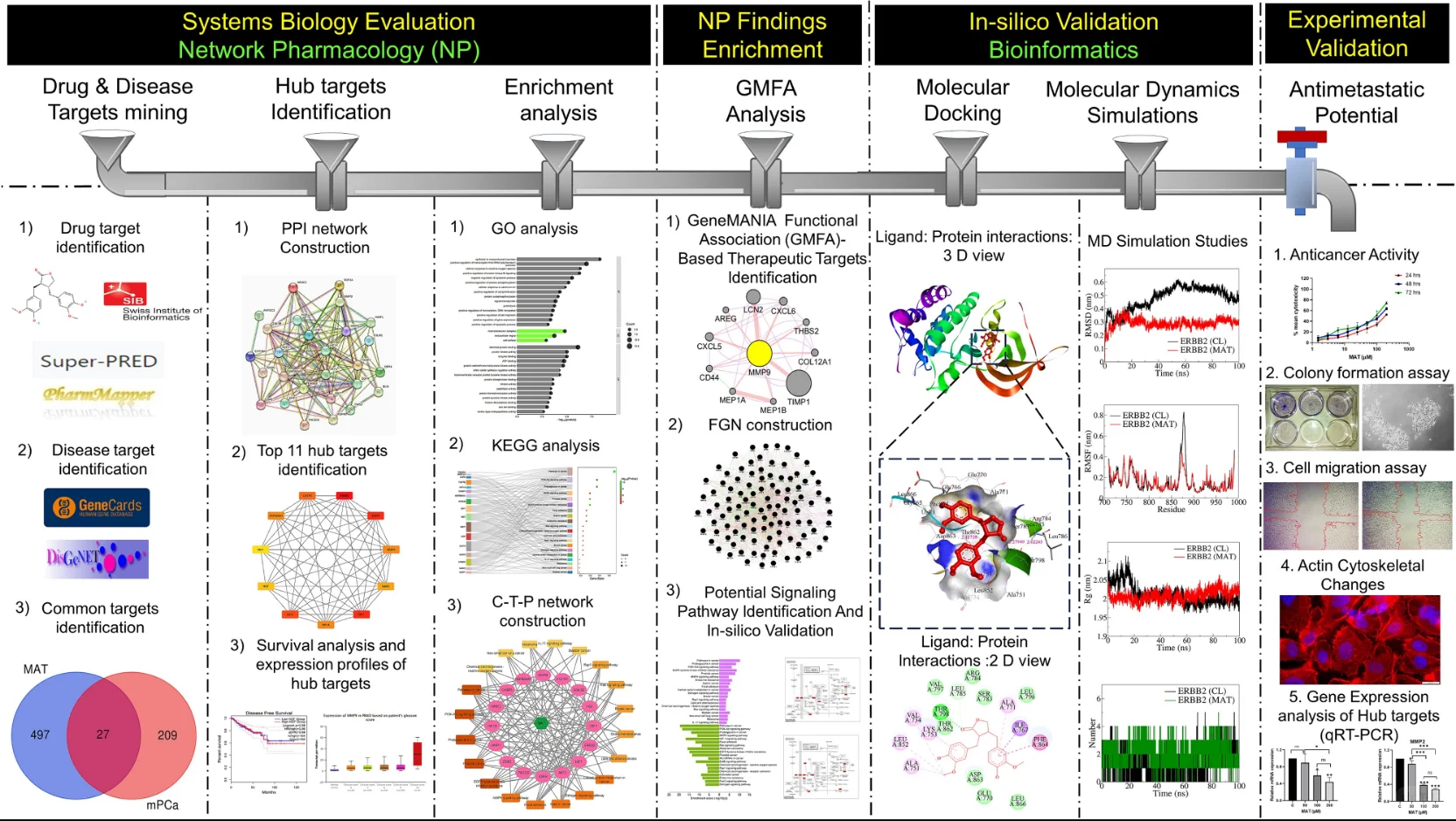
本研究构建了一套创新的系统生物学研究流程,系统性地探究了植物木脂素Matairesinol在前列腺癌中的抗转移潜力。研究采用整合性策略,核心路径分为紧密衔接的计算与实验两大模块:
1. 计算预测与假说生成
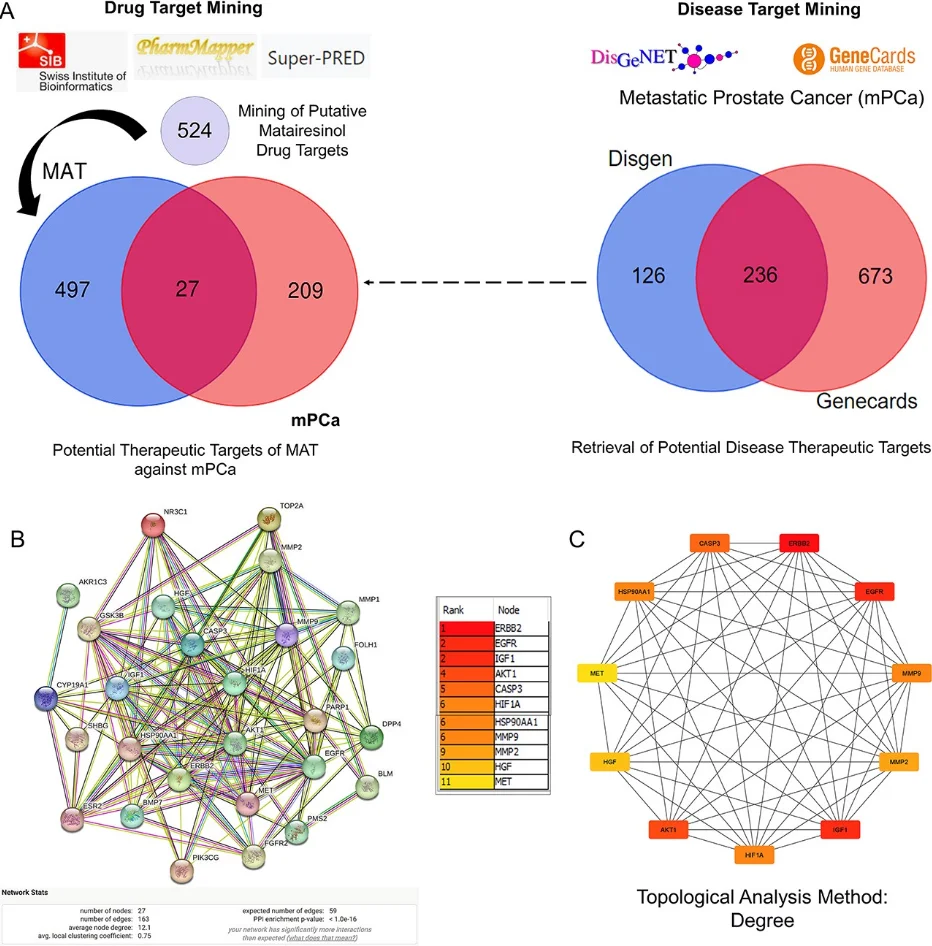
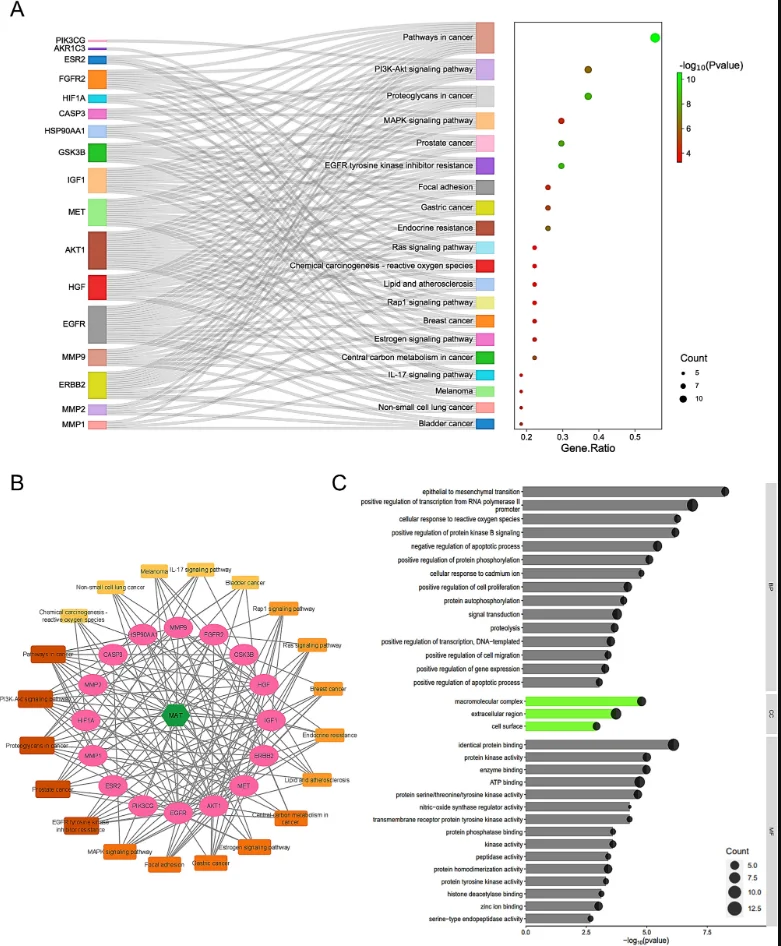
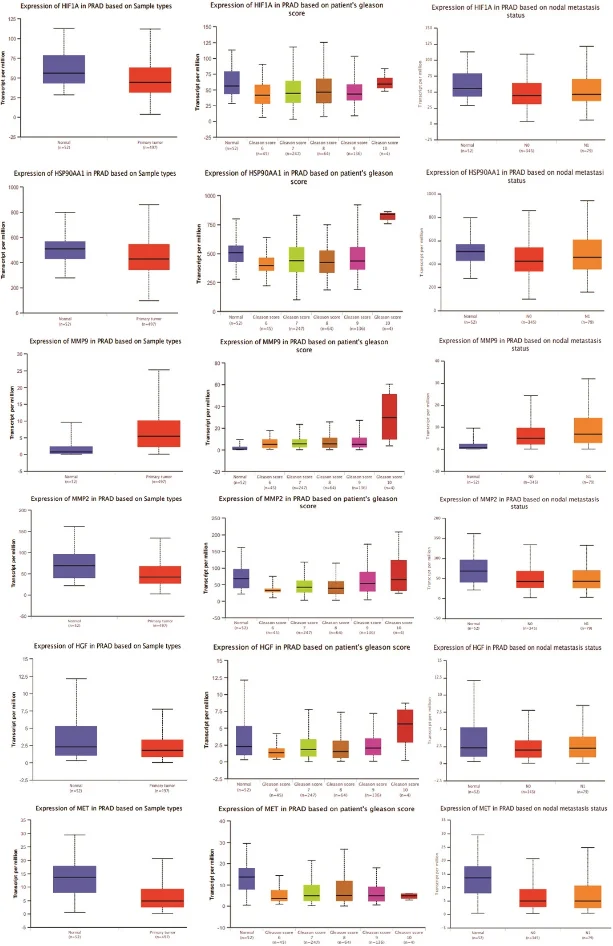
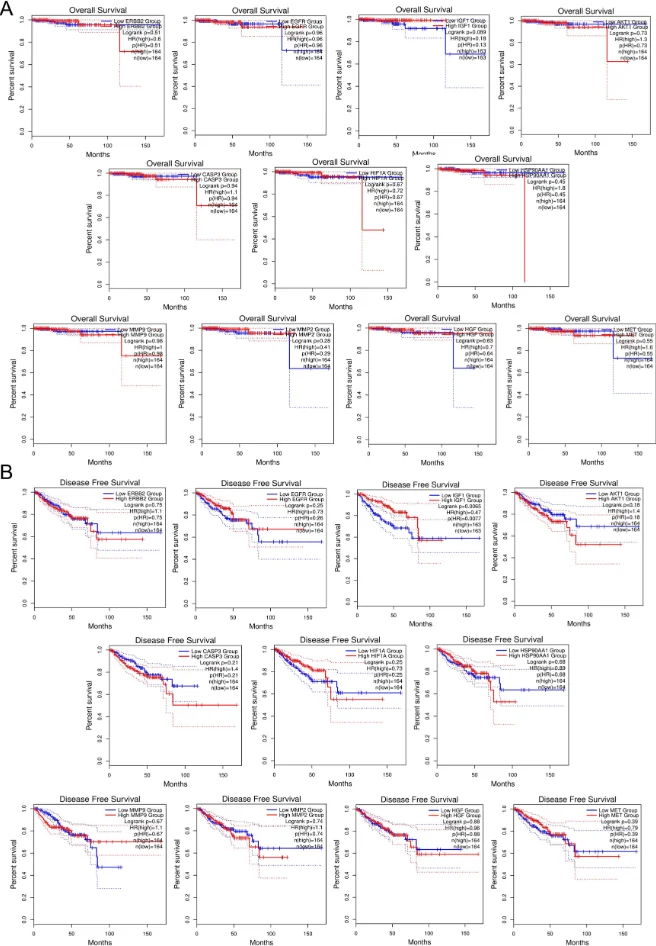
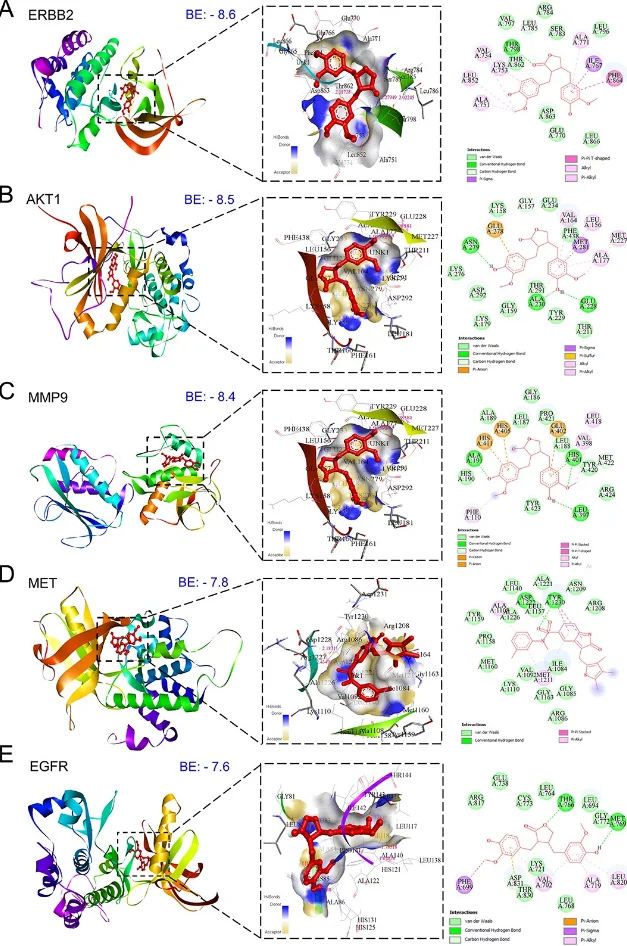
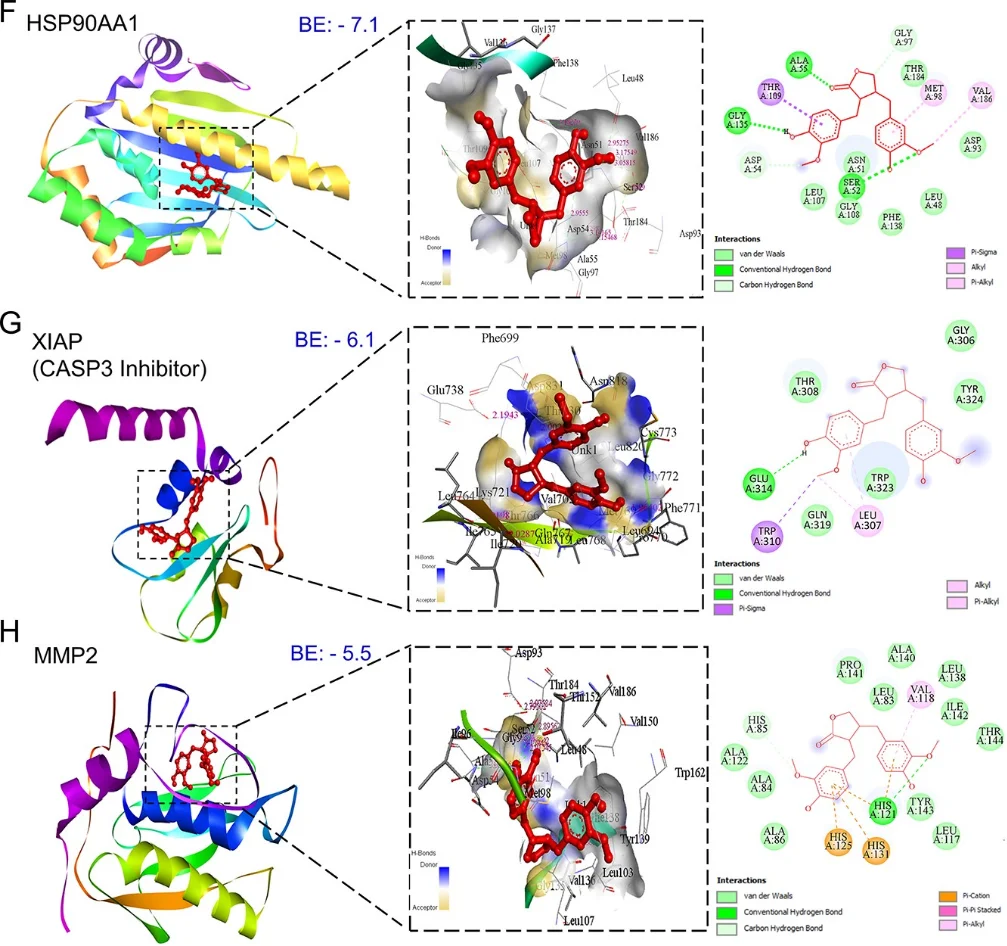
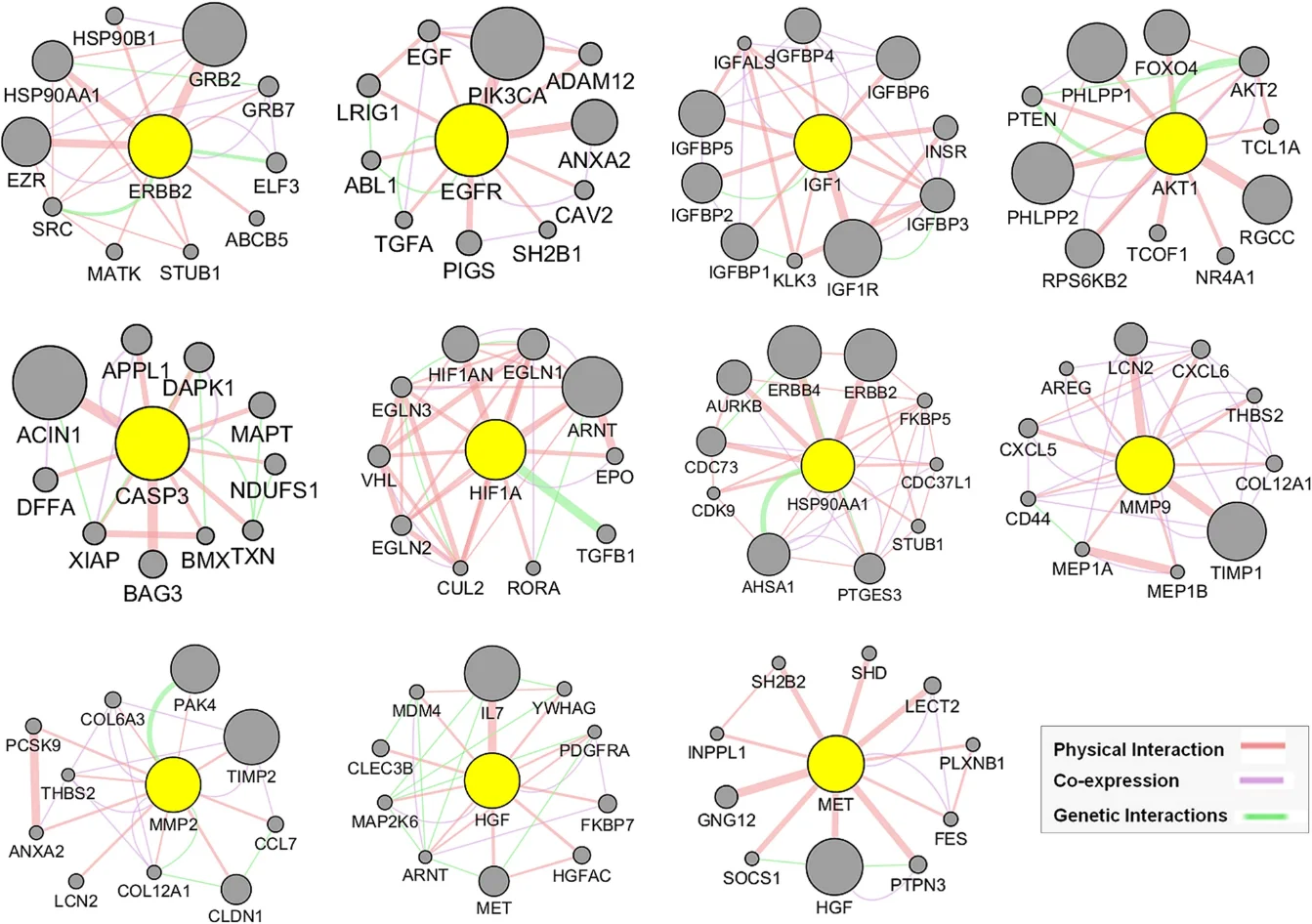
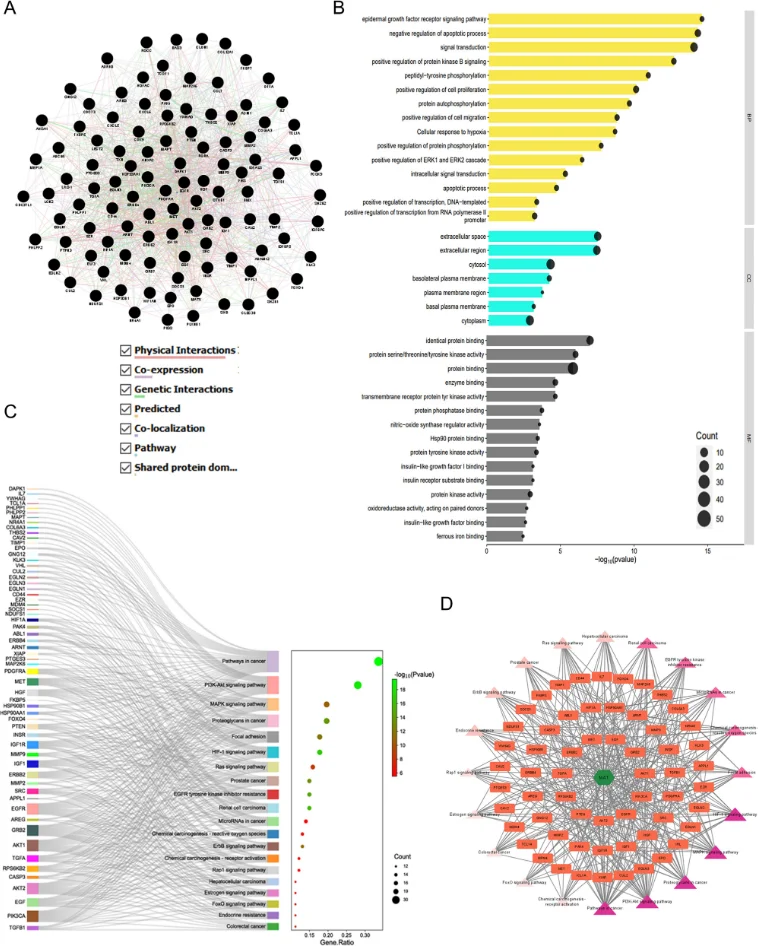
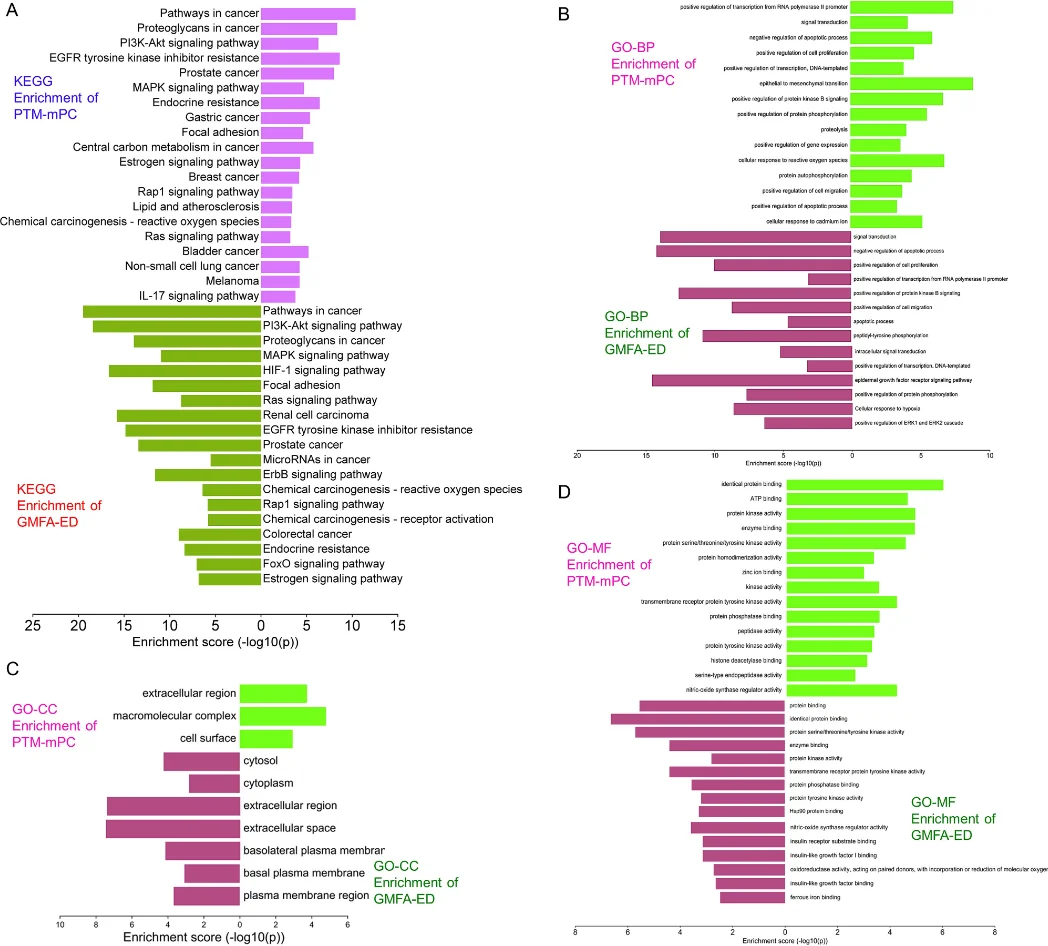
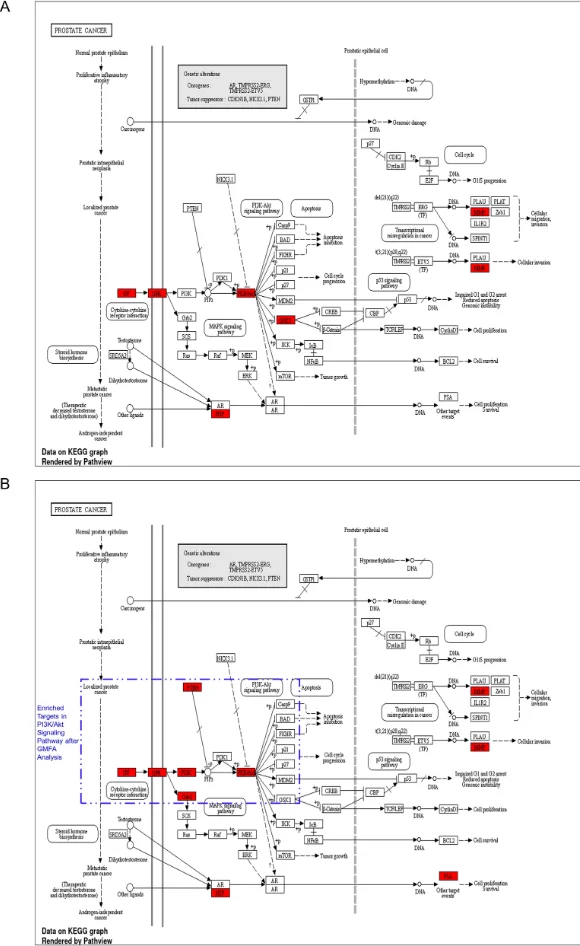
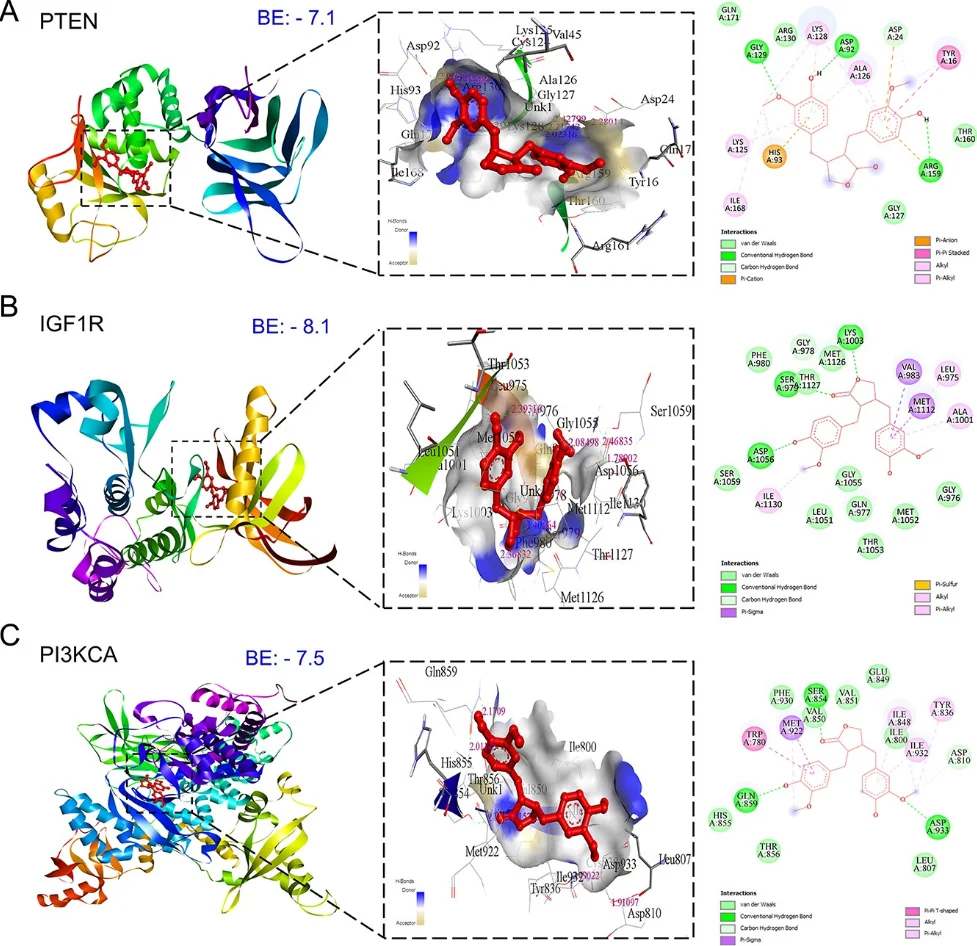
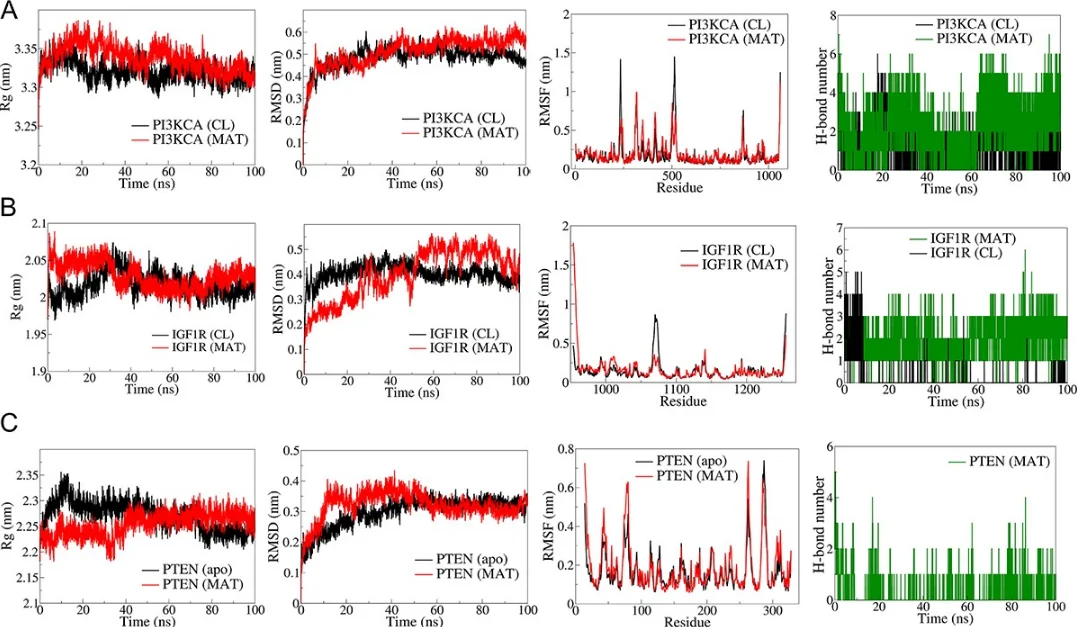
研究始于网络药理学与生物信息学分析。首先,通过逆向分子对接预测Matairesinol的潜在作用靶点集。随后,利用TCGA、GEO等公共数据库挖掘前列腺癌转移相关的关键基因。将化合物与疾病靶点进行交集,构建蛋白质相互作用网络,并通过拓扑学分析筛选出核心枢纽靶点。进一步的GO/KEGG通路富集分析表明,这些靶点显著富集于上皮-间质转化(EMT)、PI3K-Akt及MAPK信号通路等与肿瘤转移密切相关的进程中,由此形成关于其多靶点作用机制的明确科学假说。
2. 实验验证与机制确认
计算预测的假说在体外与体内模型中得到阶梯式验证。
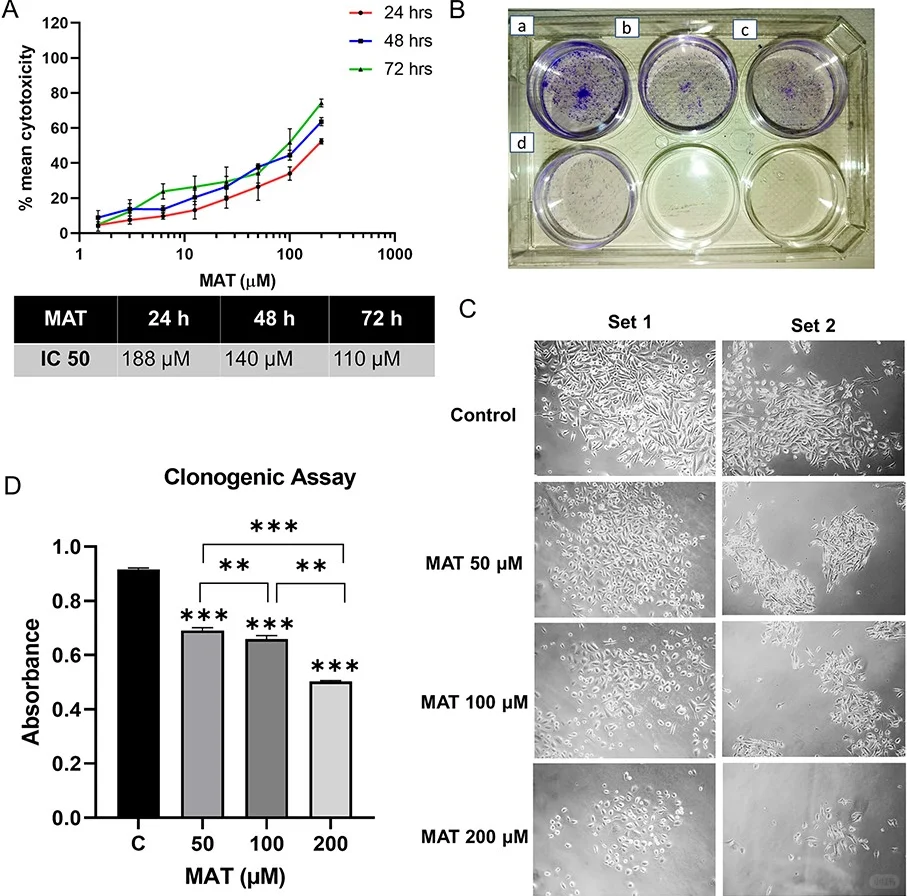
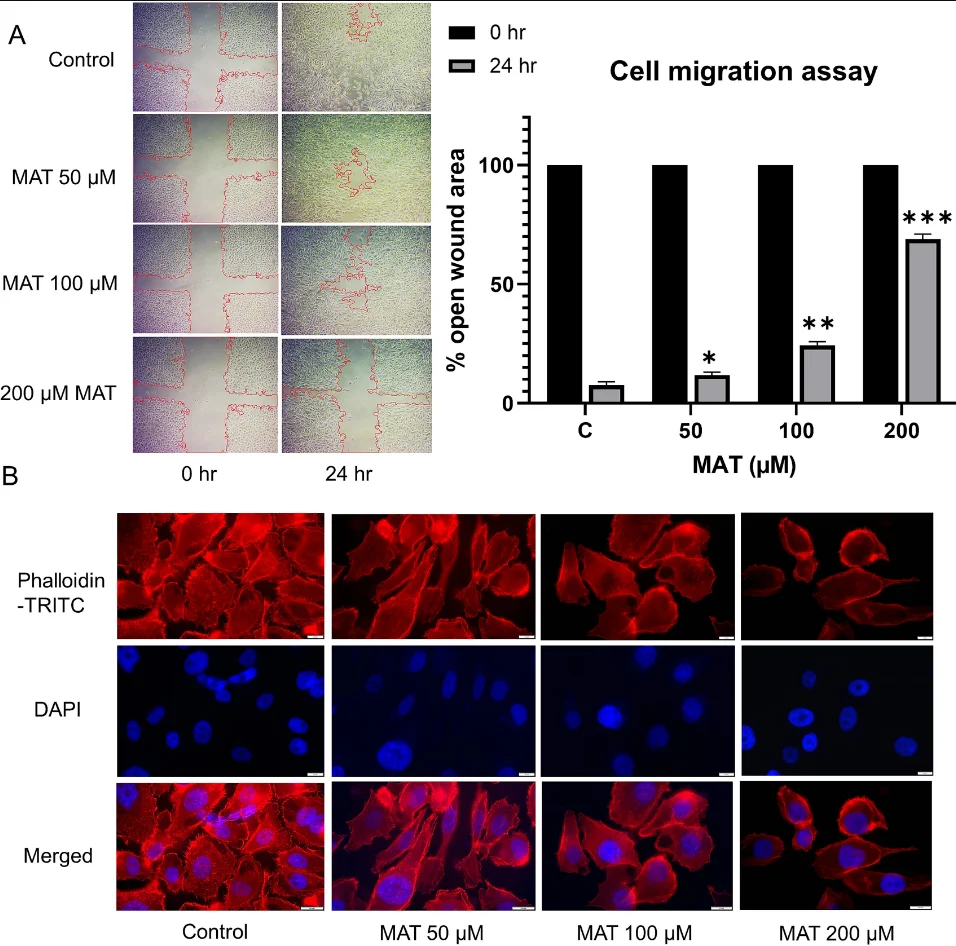
· 表型验证: 体外实验表明,Matairesinol能显著抑制前列腺癌细胞的迁移与侵袭能力。
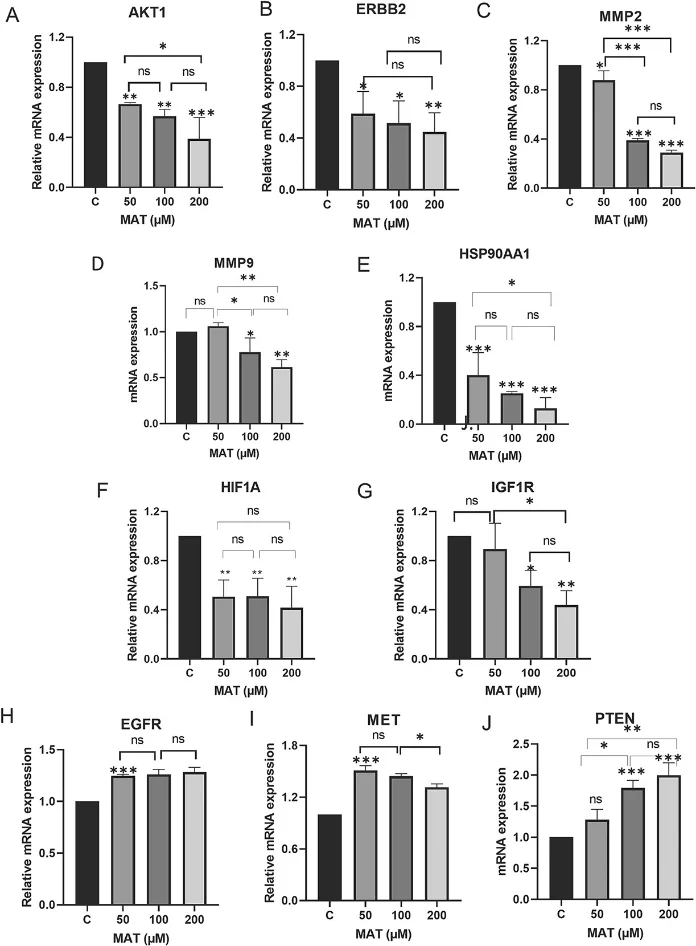
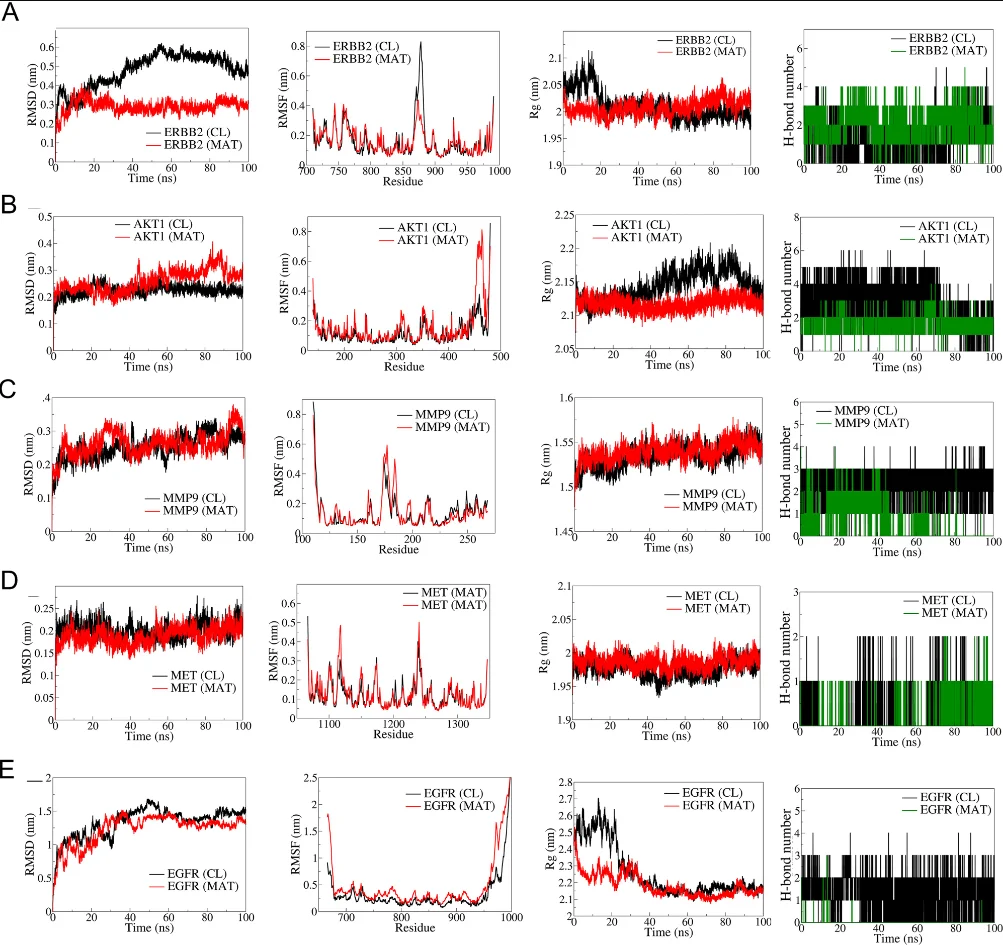
· 分子机制验证: Western Blot、qPCR等技术证实,Matairesinol处理后,预测的核心靶点(如MMP-9, VEGFA, SNAI1)表达下调,关键通路蛋白(如p-AKT)的磷酸化水平受到抑制,从而在分子层面验证了计算预测。
· 体内功能确证: 在前列腺癌转移小鼠模型中,Matairesinol治疗显著减少了肺部转移灶的形成,完成了从计算假说到活体水平功能验证的完整证据链。
---
文章亮点
1. 范式创新: 本研究确立了标准化的 “干湿实验结合”研究Pipeline(网络药理学→生物信息学→体外验证→体内确证),为系统性加速天然产物药效机制研究提供了可推广的方法论范本。
2. 系统性的机制阐释: 突破了“单靶点”思维的局限,通过系统层面的网络分析,揭示了Matairesinol通过多靶点、多通路协同发挥抗转移作用的特点,为其药效提供了坚实且全面的理论依据。
3. 明确的临床转化潜力: 精准聚焦于癌症致死的核心环节——转移,发现天然化合物Matairesinol的特异性抗转移功能,为开发前列腺癌的预防或辅助治疗策略提供了有价值的先导分子。
4. 数据驱动的精准研究: 整个研究始于对大规模生物医学数据的深度挖掘与建模,体现了 “数据驱动发现” 的现代科研理念,使研究方向更为精准,假说更具说服力。
本研究构建了一套创新的系统生物学研究流程,系统性地探究了植物木脂素Matairesinol在前列腺癌中的抗转移潜力。研究采用整合性策略,核心路径分为紧密衔接的计算与实验两大模块:
1. 计算预测与假说生成
研究始于网络药理学与生物信息学分析。首先,通过逆向分子对接预测Matairesinol的潜在作用靶点集。随后,利用TCGA、GEO等公共数据库挖掘前列腺癌转移相关的关键基因。将化合物与疾病靶点进行交集,构建蛋白质相互作用网络,并通过拓扑学分析筛选出核心枢纽靶点。进一步的GO/KEGG通路富集分析表明,这些靶点显著富集于上皮-间质转化(EMT)、PI3K-Akt及MAPK信号通路等与肿瘤转移密切相关的进程中,由此形成关于其多靶点作用机制的明确科学假说。
2. 实验验证与机制确认
计算预测的假说在体外与体内模型中得到阶梯式验证。
· 表型验证: 体外实验表明,Matairesinol能显著抑制前列腺癌细胞的迁移与侵袭能力。
· 分子机制验证: Western Blot、qPCR等技术证实,Matairesinol处理后,预测的核心靶点(如MMP-9, VEGFA, SNAI1)表达下调,关键通路蛋白(如p-AKT)的磷酸化水平受到抑制,从而在分子层面验证了计算预测。
· 体内功能确证: 在前列腺癌转移小鼠模型中,Matairesinol治疗显著减少了肺部转移灶的形成,完成了从计算假说到活体水平功能验证的完整证据链。
---
文章亮点
1. 范式创新: 本研究确立了标准化的 “干湿实验结合”研究Pipeline(网络药理学→生物信息学→体外验证→体内确证),为系统性加速天然产物药效机制研究提供了可推广的方法论范本。
2. 系统性的机制阐释: 突破了“单靶点”思维的局限,通过系统层面的网络分析,揭示了Matairesinol通过多靶点、多通路协同发挥抗转移作用的特点,为其药效提供了坚实且全面的理论依据。
3. 明确的临床转化潜力: 精准聚焦于癌症致死的核心环节——转移,发现天然化合物Matairesinol的特异性抗转移功能,为开发前列腺癌的预防或辅助治疗策略提供了有价值的先导分子。
4. 数据驱动的精准研究: 整个研究始于对大规模生物医学数据的深度挖掘与建模,体现了 “数据驱动发现” 的现代科研理念,使研究方向更为精准,假说更具说服力。


