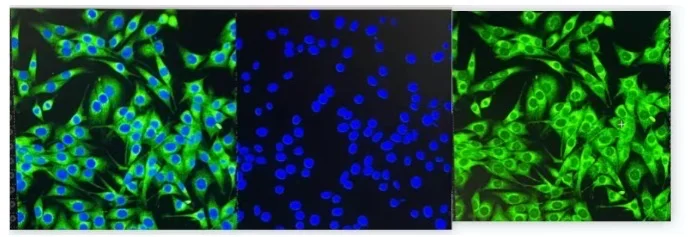
ж ·жң¬еүҚеӨ„зҗҶ
з»Ҷиғһжё…жҙ—
еҗёејғеҹ№е…»еҹәпјҢдҪҝз”ЁPBSиҪ»жҹ”жјӮжҙ—3ж¬ЎпјҢжҜҸж¬Ў5еҲҶй’ҹгҖӮз»Ҷиғһеӣәе®ҡ
йҮҮз”Ё4%еӨҡиҒҡз”ІйҶӣпјҲPFAпјүе®Өжё©еӣәе®ҡ15еҲҶй’ҹпјҢPBSжјӮжҙ—3ж¬ЎгҖӮе»әи®®ж”№з”Ёйў„еҶ·иҮівҖ“20В°Cзҡ„еҶ°з”ІйҶҮеӣәе®ҡ10еҲҶй’ҹпјҢеҸҜжҳҫи‘—жҸҗй«ҳжҠ—еҺҹдҝқз•ҷж•ҲжһңдёҺдҝЎеҷӘжҜ”гҖӮ
йҖҡйҖҸдёҺе°Ғй—ӯ
з»ҶиғһиҶңйҖҡйҖҸ
дҪҝз”Ё0.1% Triton X-100е®Өжё©йҖҡйҖҸ15еҲҶй’ҹпјҢPBSжјӮжҙ—3ж¬ЎгҖӮ
йқһзү№ејӮжҖ§дҪҚзӮ№е°Ғй—ӯ
дҪҝз”Ё10% BSAе®Өжё©е°Ғй—ӯ1е°Ҹж—¶пјҢPBSжјӮжҙ—3ж¬ЎгҖӮ
жҠ—дҪ“еӯөиӮІ
дёҖжҠ—еӯөиӮІ
жҢү1:300жҜ”дҫӢдҪҝз”ЁжҠ—дҪ“зЁҖйҮҠж¶ІзЁҖйҮҠдёҖжҠ—пјҢ4В°CеӯөиӮІиҝҮеӨңгҖӮ
з»“жқҹеҗҺдҪҝз”ЁPBSжјӮжҙ—3ж¬ЎгҖӮ
дәҢжҠ—еӯөиӮІ
жҢү1:1000жҜ”дҫӢдҪҝз”ЁжҠ—дҪ“зЁҖйҮҠж¶ІзЁҖйҮҠдәҢжҠ—пјҢе®Өжё©йҒҝе…үеӯөиӮІ1е°Ҹж—¶гҖӮ
PBSжјӮжҙ—3ж¬ЎгҖӮ
ж ёжҹ“иүІдёҺй•ңжЈҖ
з»Ҷиғһж ёжҹ“иүІ
дҪҝз”ЁHoechst 33342е®Өжё©йҒҝе…үжҹ“иүІ6еҲҶй’ҹпјҢPBSжјӮжҙ—3ж¬ЎгҖӮ
е°ҒзүҮдёҺжҲҗеғҸ
жҜҸзҡҝеҠ е…Ҙ300 ВөL PBSпјҢдҪҝз”Ёе…ұиҒҡз„Ұжҳҫеҫ®й•ңиҝӣиЎҢеӣҫеғҸйҮҮйӣҶгҖӮ
е®һйӘҢжіЁж„ҸдәӢйЎ№
жҠ—дҪ“зЁҖйҮҠпјҡе»әи®®дҪҝз”Ёе•Ҷе“ҒеҢ–жҠ—дҪ“зЁҖйҮҠж¶ІпјҢе…·дҪ“зЁҖйҮҠжҜ”дҫӢиҜ·еҸӮиҖғеҗ„жҠ—дҪ“иҜҙжҳҺд№ҰгҖӮ
з»ҶиғһзҠ¶жҖҒпјҡз»ҶиғһзҠ¶жҖҒеҜ№жҹ“иүІиҙЁйҮҸиҮіе…ійҮҚиҰҒгҖӮиӢҘз»ҶиғһеӯҳеңЁиҪ»еәҰжұЎжҹ“жҲ–иғҢжҷҜдёҚе№ІеҮҖпјҢе°Ҷжҳҫи‘—еҪұе“ҚжҲҗеғҸиҙЁйҮҸгҖӮ
ж–№жі•е·®ејӮпјҡдёҚеҗҢе®һйӘҢе®ӨеңЁжҹ“иүІжқЎд»¶дёҠеҸҜиғҪеӯҳеңЁе·®ејӮпјҢжң¬ж–№жЎҲд»…дҫӣеҸӮиҖғпјҢиҜ·ж №жҚ®е®һйҷ…дҪ“зі»дјҳеҢ–гҖӮ
з»Ҷиғһжё…жҙ—
еҗёејғеҹ№е…»еҹәпјҢдҪҝз”ЁPBSиҪ»жҹ”жјӮжҙ—3ж¬ЎпјҢжҜҸж¬Ў5еҲҶй’ҹгҖӮз»Ҷиғһеӣәе®ҡ
йҮҮз”Ё4%еӨҡиҒҡз”ІйҶӣпјҲPFAпјүе®Өжё©еӣәе®ҡ15еҲҶй’ҹпјҢPBSжјӮжҙ—3ж¬ЎгҖӮе»әи®®ж”№з”Ёйў„еҶ·иҮівҖ“20В°Cзҡ„еҶ°з”ІйҶҮеӣәе®ҡ10еҲҶй’ҹпјҢеҸҜжҳҫи‘—жҸҗй«ҳжҠ—еҺҹдҝқз•ҷж•ҲжһңдёҺдҝЎеҷӘжҜ”гҖӮ
йҖҡйҖҸдёҺе°Ғй—ӯ
з»ҶиғһиҶңйҖҡйҖҸ
дҪҝз”Ё0.1% Triton X-100е®Өжё©йҖҡйҖҸ15еҲҶй’ҹпјҢPBSжјӮжҙ—3ж¬ЎгҖӮ
йқһзү№ејӮжҖ§дҪҚзӮ№е°Ғй—ӯ
дҪҝз”Ё10% BSAе®Өжё©е°Ғй—ӯ1е°Ҹж—¶пјҢPBSжјӮжҙ—3ж¬ЎгҖӮ
жҠ—дҪ“еӯөиӮІ
дёҖжҠ—еӯөиӮІ
жҢү1:300жҜ”дҫӢдҪҝз”ЁжҠ—дҪ“зЁҖйҮҠж¶ІзЁҖйҮҠдёҖжҠ—пјҢ4В°CеӯөиӮІиҝҮеӨңгҖӮ
з»“жқҹеҗҺдҪҝз”ЁPBSжјӮжҙ—3ж¬ЎгҖӮ
дәҢжҠ—еӯөиӮІ
жҢү1:1000жҜ”дҫӢдҪҝз”ЁжҠ—дҪ“зЁҖйҮҠж¶ІзЁҖйҮҠдәҢжҠ—пјҢе®Өжё©йҒҝе…үеӯөиӮІ1е°Ҹж—¶гҖӮ
PBSжјӮжҙ—3ж¬ЎгҖӮ
ж ёжҹ“иүІдёҺй•ңжЈҖ
з»Ҷиғһж ёжҹ“иүІ
дҪҝз”ЁHoechst 33342е®Өжё©йҒҝе…үжҹ“иүІ6еҲҶй’ҹпјҢPBSжјӮжҙ—3ж¬ЎгҖӮ
е°ҒзүҮдёҺжҲҗеғҸ
жҜҸзҡҝеҠ е…Ҙ300 ВөL PBSпјҢдҪҝз”Ёе…ұиҒҡз„Ұжҳҫеҫ®й•ңиҝӣиЎҢеӣҫеғҸйҮҮйӣҶгҖӮ
е®һйӘҢжіЁж„ҸдәӢйЎ№
жҠ—дҪ“зЁҖйҮҠпјҡе»әи®®дҪҝз”Ёе•Ҷе“ҒеҢ–жҠ—дҪ“зЁҖйҮҠж¶ІпјҢе…·дҪ“зЁҖйҮҠжҜ”дҫӢиҜ·еҸӮиҖғеҗ„жҠ—дҪ“иҜҙжҳҺд№ҰгҖӮ
з»ҶиғһзҠ¶жҖҒпјҡз»ҶиғһзҠ¶жҖҒеҜ№жҹ“иүІиҙЁйҮҸиҮіе…ійҮҚиҰҒгҖӮиӢҘз»ҶиғһеӯҳеңЁиҪ»еәҰжұЎжҹ“жҲ–иғҢжҷҜдёҚе№ІеҮҖпјҢе°Ҷжҳҫи‘—еҪұе“ҚжҲҗеғҸиҙЁйҮҸгҖӮ
ж–№жі•е·®ејӮпјҡдёҚеҗҢе®һйӘҢе®ӨеңЁжҹ“иүІжқЎд»¶дёҠеҸҜиғҪеӯҳеңЁе·®ејӮпјҢжң¬ж–№жЎҲд»…дҫӣеҸӮиҖғпјҢиҜ·ж №жҚ®е®һйҷ…дҪ“зі»дјҳеҢ–гҖӮ


