е…Қз–«иҚ§е…үжҹ“иүІжңүе“ӘдәӣжҠҖжңҜиҰҒзӮ№
дёҖгҖҒжҠҖжңҜеҲҶзұ»
1. зӣҙжҺҘе…Қз–«иҚ§е…ү
еҺҹзҗҶпјҡиҚ§е…үзҙ зӣҙжҺҘж Үи®°дёҖжҠ—пјҢдёҺйқ¶жҠ—еҺҹз»“еҗҲеҗҺзӣҙжҺҘи§ӮеҜҹгҖӮ
дјҳзӮ№пјҡжӯҘйӘӨз®ҖеҚ•пјҢйқһзү№ејӮжҖ§з»“еҗҲе°‘гҖӮ
зјәзӮ№пјҡзҒөж•ҸеәҰиҫғдҪҺпјҢдёҖжҠ—йңҖеҚ•зӢ¬ж Үи®°гҖӮ
2. й—ҙжҺҘе…Қз–«иҚ§е…ү
в—Ұ еҺҹзҗҶпјҡдёҖжҠ—дёҺжҠ—еҺҹз»“еҗҲеҗҺпјҢиҚ§е…үзҙ ж Үи®°зҡ„дәҢжҠ—пјҲй’ҲеҜ№дёҖжҠ—пјүеҶҚз»“еҗҲгҖӮ
в—Ұ дјҳзӮ№пјҡдҝЎеҸ·ж”ҫеӨ§пјҢзҒөж•ҸеәҰй«ҳпјҢйҖҡз”ЁжҖ§ејәгҖӮ
в—Ұ зјәзӮ№пјҡжӯҘйӘӨиҫғеӨҡпјҢеҸҜиғҪеўһеҠ иғҢжҷҜеҷӘеЈ°гҖӮ
дәҢгҖҒе…ій”®е®һйӘҢжӯҘйӘӨеҸҠиҰҒзӮ№
1. ж ·жң¬еҲ¶еӨҮ
вҖў з»Ҷиғһж ·жң¬пјҡ
в—Ұ иҙҙеЈҒз»Ҷиғһпјҡ4%еӨҡиҒҡз”ІйҶӣеӣәе®ҡпјҲ10-15еҲҶй’ҹпјүпјҢйҖҸиҶңпјҲ0.1% Triton X-100пјҢ5еҲҶй’ҹпјүгҖӮ
в—Ұ жӮ¬жө®з»ҶиғһпјҡзҰ»еҝғеҗҺж¶ӮзүҮпјҢйҒҝе…Қз»ҶиғһдёўеӨұгҖӮ
вҖў з»„з»Үж ·жң¬пјҡ
в—Ұ зҹіиңЎеҲҮзүҮйңҖи„ұиңЎгҖҒж°ҙеҢ–пјӣеҶ°еҶ»еҲҮзүҮзӣҙжҺҘеӣәе®ҡпјҢжіЁж„ҸйҳІи„ұзүҮгҖӮ
вҖў е…ій”®зӮ№пјҡ
в—Ұ йҒҝе…ҚиҝҮеәҰеӣәе®ҡпјҲжҠ—еҺҹиЎЁдҪҚеҸҜиғҪиў«жҺ©зӣ–пјүгҖӮ
в—Ұ йҖҸиҶңж—¶й—ҙйңҖдјҳеҢ–пјҲиҝҮеәҰйҖҸиҶңз ҙеқҸз»Ҷиғһз»“жһ„пјүгҖӮ
2. жҠ—дҪ“еӯөиӮІ
вҖў дёҖжҠ—йҖүжӢ©пјҡ
в—Ұ йӘҢиҜҒзү№ејӮжҖ§пјҲKOж ·жң¬жҲ–Western BlotзЎ®и®ӨпјүгҖӮ
в—Ұ зЁҖйҮҠжҜ”дҫӢйңҖйў„е®һйӘҢпјҲеёёз”Ё1:100-1:500пјүгҖӮ
вҖў еӯөиӮІжқЎд»¶пјҡ
в—Ұ 4в„ғиҝҮеӨңпјҲзү№ејӮжҖ§з»“еҗҲжӣҙдҪіпјүжҲ–е®Өжё©1-2е°Ҹж—¶гҖӮ
в—Ұ ж№ҝзӣ’еҶ…ж“ҚдҪңпјҢйҳІжӯўе№ІзҮҘгҖӮ
вҖў дәҢжҠ—йҖүжӢ©пјҡ
еҢ№й…ҚдёҖжҠ—з§ҚеұһгҖӮ
йҒҝе…ҚдәӨеҸүеҸҚеә”гҖӮ
3. иҚ§е…үж Үи®°дёҺжЈҖжөӢ
вҖў иҚ§е…үзҙ йҖүжӢ©пјҡ
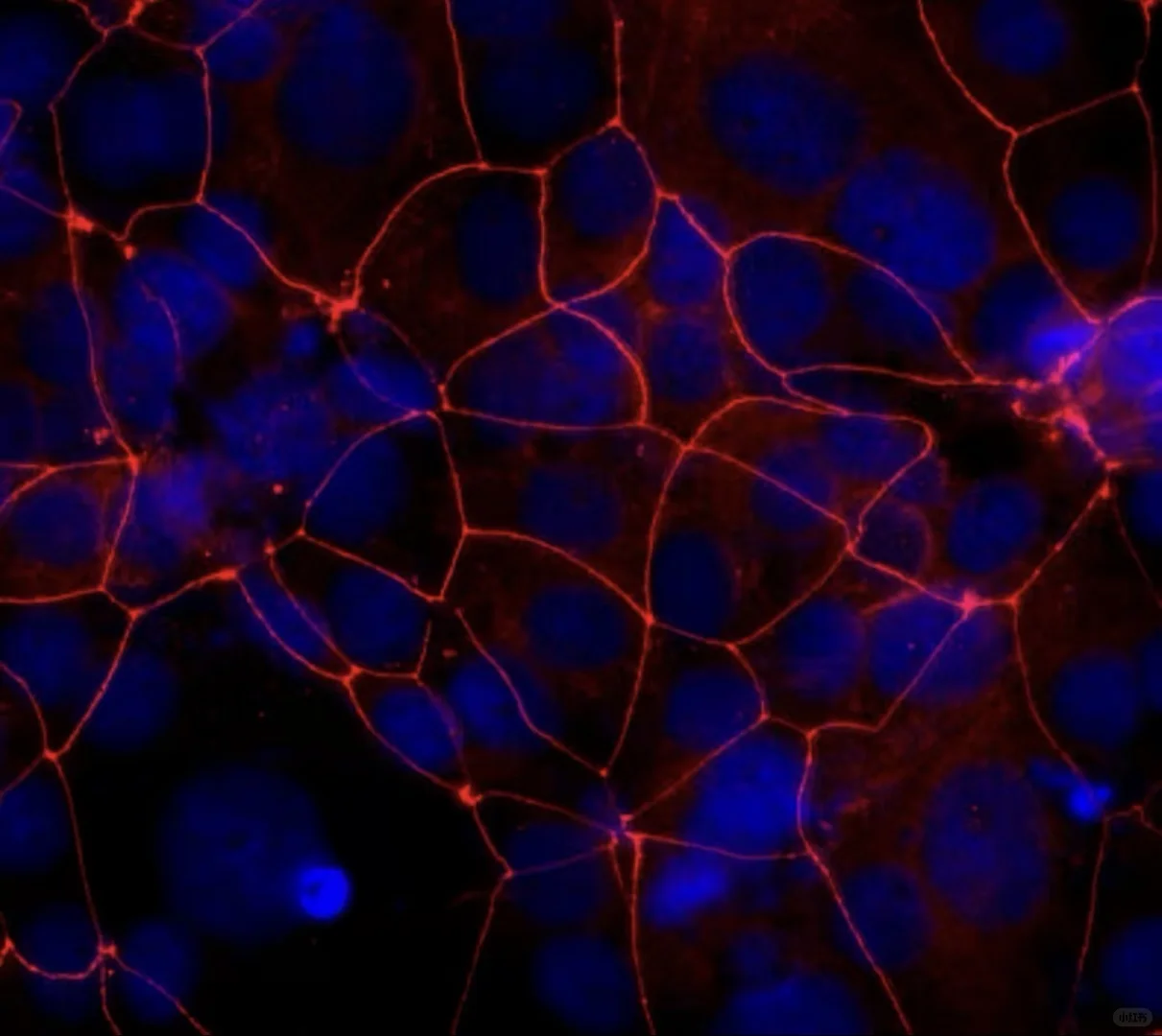
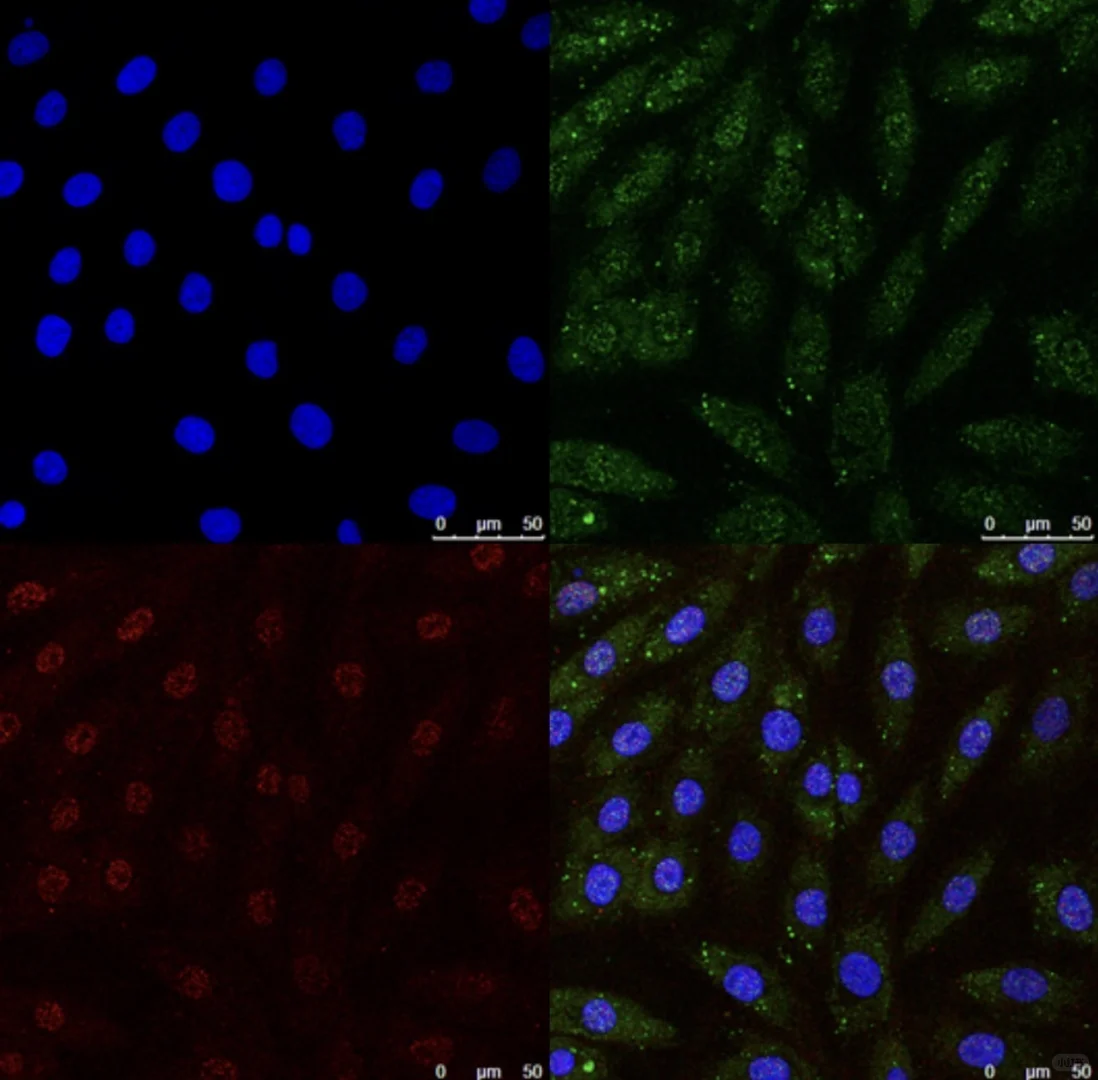
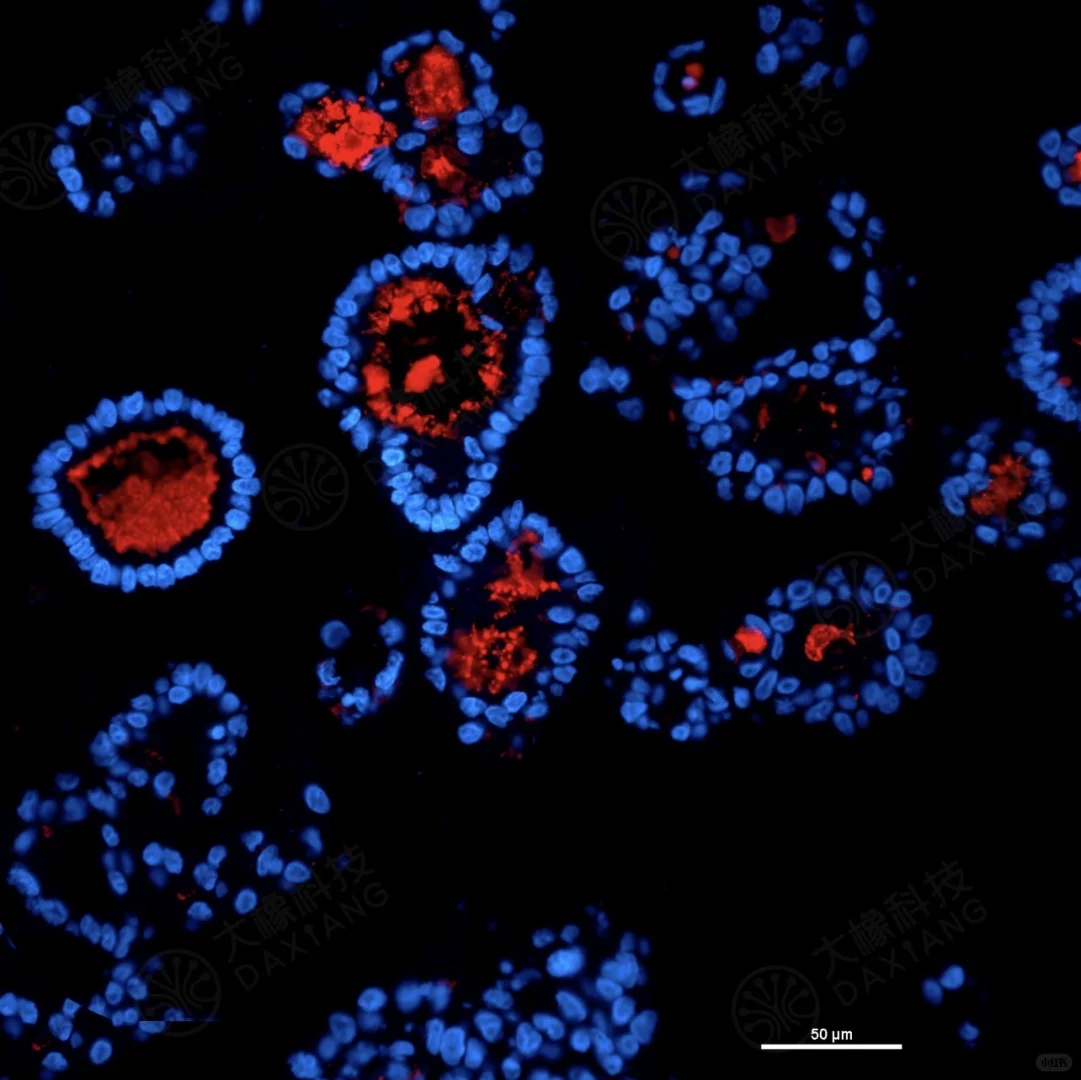
в—Ұ еёёз”ЁпјҡFITCпјҲз»ҝиүІпјүгҖҒCy3пјҲзәўиүІпјүгҖҒDAPIпјҲи“қиүІж ёжҹ“пјүгҖӮ
в—Ұ еӨҡиүІе®һйӘҢпјҡйҖүжӢ©е…үи°ұдёҚйҮҚеҸ зҡ„иҚ§е…үзҙ пјҲеҰӮAlexa Fluorзі»еҲ—пјүгҖӮ
вҖў е°ҒзүҮпјҡ
в—Ұ жҠ—ж·¬зҒӯе°ҒзүҮеүӮпјҢ延缓иҚ§е…үиЎ°еҮҸгҖӮ
вҖў е…ій”®зӮ№пјҡ
в—Ұ йҒҝе…үж“ҚдҪңпјҲйҳІжӯўиҚ§е…үж·¬зҒӯпјүгҖӮ
в—Ұ и®ҫзҪ®йҳҙжҖ§еҜ№з…§пјҲжңӘеҠ дёҖжҠ—жҲ–еҗҢеһӢеҜ№з…§пјүгҖӮ
дёүгҖҒеёёи§Ғй—®йўҳеҸҠи§ЈеҶіж–№жЎҲ
1. й«ҳиғҢжҷҜеҷӘеЈ°
в—Ұ еҺҹеӣ пјҡжҠ—дҪ“жө“еәҰиҝҮй«ҳгҖҒйқһзү№ејӮжҖ§з»“еҗҲгҖҒж ·жң¬иҮӘеҸ‘иҚ§е…үгҖӮ
в—Ұ и§ЈеҶіпјҡдјҳеҢ–жҠ—дҪ“зЁҖйҮҠеәҰпјҢеўһеҠ е°Ғй—ӯж—¶й—ҙпјҲ5% BSAжҲ–иЎҖжё…пјүпјҢзј©зҹӯжӣқе…үж—¶й—ҙгҖӮ
2. дҝЎеҸ·ејұжҲ–ж— дҝЎеҸ·
в—Ұ еҺҹеӣ пјҡжҠ—еҺҹиЎЁдҪҚиў«з ҙеқҸгҖҒжҠ—дҪ“еӨұж•ҲгҖҒиҚ§е…үж·¬зҒӯгҖӮ
в—Ұ и§ЈеҶіпјҡжӣҙжҚўеӣәе®ҡж–№жі•пјҲеҰӮз”ІйҶҮжӣҝд»ЈеӨҡиҒҡз”ІйҶӣпјүпјҢйӘҢиҜҒжҠ—дҪ“жҙ»жҖ§пјҢж–°йІңй…ҚеҲ¶иҚ§е…үдәҢжҠ—гҖӮ
3. йқһзү№ејӮжҖ§жҹ“иүІ
в—Ұ еҺҹеӣ пјҡдәҢжҠ—дәӨеҸүеҸҚеә”гҖҒеҶ…жәҗжҖ§IgGз»“еҗҲгҖӮ
в—Ұ и§ЈеҶіпјҡдҪҝз”Ёз§Қеұһзү№ејӮжҖ§дәҢжҠ—пјҢйў„еҗёйҷ„дәҢжҠ—жҲ–йҳ»ж–ӯеҶ…жәҗжҖ§IgGпјҲеҰӮеұұзҫҠиЎҖжё…пјүгҖӮ
4. иҚ§е…үж·¬зҒӯеҝ«
в—Ұ еҺҹеӣ пјҡе°ҒзүҮдёҚеҪ“жҲ–е…үз…§иҝҮеәҰгҖӮ
в—Ұ и§ЈеҶіпјҡдҪҝз”ЁжҠ—ж·¬зҒӯеүӮпјҢйҒҝе…үдҝқеӯҳж ·жң¬гҖӮ
дёҖгҖҒжҠҖжңҜеҲҶзұ»
1. зӣҙжҺҘе…Қз–«иҚ§е…ү
еҺҹзҗҶпјҡиҚ§е…үзҙ зӣҙжҺҘж Үи®°дёҖжҠ—пјҢдёҺйқ¶жҠ—еҺҹз»“еҗҲеҗҺзӣҙжҺҘи§ӮеҜҹгҖӮ
дјҳзӮ№пјҡжӯҘйӘӨз®ҖеҚ•пјҢйқһзү№ејӮжҖ§з»“еҗҲе°‘гҖӮ
зјәзӮ№пјҡзҒөж•ҸеәҰиҫғдҪҺпјҢдёҖжҠ—йңҖеҚ•зӢ¬ж Үи®°гҖӮ
2. й—ҙжҺҘе…Қз–«иҚ§е…ү
в—Ұ еҺҹзҗҶпјҡдёҖжҠ—дёҺжҠ—еҺҹз»“еҗҲеҗҺпјҢиҚ§е…үзҙ ж Үи®°зҡ„дәҢжҠ—пјҲй’ҲеҜ№дёҖжҠ—пјүеҶҚз»“еҗҲгҖӮ
в—Ұ дјҳзӮ№пјҡдҝЎеҸ·ж”ҫеӨ§пјҢзҒөж•ҸеәҰй«ҳпјҢйҖҡз”ЁжҖ§ејәгҖӮ
в—Ұ зјәзӮ№пјҡжӯҘйӘӨиҫғеӨҡпјҢеҸҜиғҪеўһеҠ иғҢжҷҜеҷӘеЈ°гҖӮ
дәҢгҖҒе…ій”®е®һйӘҢжӯҘйӘӨеҸҠиҰҒзӮ№
1. ж ·жң¬еҲ¶еӨҮ
вҖў з»Ҷиғһж ·жң¬пјҡ
в—Ұ иҙҙеЈҒз»Ҷиғһпјҡ4%еӨҡиҒҡз”ІйҶӣеӣәе®ҡпјҲ10-15еҲҶй’ҹпјүпјҢйҖҸиҶңпјҲ0.1% Triton X-100пјҢ5еҲҶй’ҹпјүгҖӮ
в—Ұ жӮ¬жө®з»ҶиғһпјҡзҰ»еҝғеҗҺж¶ӮзүҮпјҢйҒҝе…Қз»ҶиғһдёўеӨұгҖӮ
вҖў з»„з»Үж ·жң¬пјҡ
в—Ұ зҹіиңЎеҲҮзүҮйңҖи„ұиңЎгҖҒж°ҙеҢ–пјӣеҶ°еҶ»еҲҮзүҮзӣҙжҺҘеӣәе®ҡпјҢжіЁж„ҸйҳІи„ұзүҮгҖӮ
вҖў е…ій”®зӮ№пјҡ
в—Ұ йҒҝе…ҚиҝҮеәҰеӣәе®ҡпјҲжҠ—еҺҹиЎЁдҪҚеҸҜиғҪиў«жҺ©зӣ–пјүгҖӮ
в—Ұ йҖҸиҶңж—¶й—ҙйңҖдјҳеҢ–пјҲиҝҮеәҰйҖҸиҶңз ҙеқҸз»Ҷиғһз»“жһ„пјүгҖӮ
2. жҠ—дҪ“еӯөиӮІ
вҖў дёҖжҠ—йҖүжӢ©пјҡ
в—Ұ йӘҢиҜҒзү№ејӮжҖ§пјҲKOж ·жң¬жҲ–Western BlotзЎ®и®ӨпјүгҖӮ
в—Ұ зЁҖйҮҠжҜ”дҫӢйңҖйў„е®һйӘҢпјҲеёёз”Ё1:100-1:500пјүгҖӮ
вҖў еӯөиӮІжқЎд»¶пјҡ
в—Ұ 4в„ғиҝҮеӨңпјҲзү№ејӮжҖ§з»“еҗҲжӣҙдҪіпјүжҲ–е®Өжё©1-2е°Ҹж—¶гҖӮ
в—Ұ ж№ҝзӣ’еҶ…ж“ҚдҪңпјҢйҳІжӯўе№ІзҮҘгҖӮ
вҖў дәҢжҠ—йҖүжӢ©пјҡ
еҢ№й…ҚдёҖжҠ—з§ҚеұһгҖӮ
йҒҝе…ҚдәӨеҸүеҸҚеә”гҖӮ
3. иҚ§е…үж Үи®°дёҺжЈҖжөӢ
вҖў иҚ§е…үзҙ йҖүжӢ©пјҡ
в—Ұ еёёз”ЁпјҡFITCпјҲз»ҝиүІпјүгҖҒCy3пјҲзәўиүІпјүгҖҒDAPIпјҲи“қиүІж ёжҹ“пјүгҖӮ
в—Ұ еӨҡиүІе®һйӘҢпјҡйҖүжӢ©е…үи°ұдёҚйҮҚеҸ зҡ„иҚ§е…үзҙ пјҲеҰӮAlexa Fluorзі»еҲ—пјүгҖӮ
вҖў е°ҒзүҮпјҡ
в—Ұ жҠ—ж·¬зҒӯе°ҒзүҮеүӮпјҢ延缓иҚ§е…үиЎ°еҮҸгҖӮ
вҖў е…ій”®зӮ№пјҡ
в—Ұ йҒҝе…үж“ҚдҪңпјҲйҳІжӯўиҚ§е…үж·¬зҒӯпјүгҖӮ
в—Ұ и®ҫзҪ®йҳҙжҖ§еҜ№з…§пјҲжңӘеҠ дёҖжҠ—жҲ–еҗҢеһӢеҜ№з…§пјүгҖӮ
дёүгҖҒеёёи§Ғй—®йўҳеҸҠи§ЈеҶіж–№жЎҲ
1. й«ҳиғҢжҷҜеҷӘеЈ°
в—Ұ еҺҹеӣ пјҡжҠ—дҪ“жө“еәҰиҝҮй«ҳгҖҒйқһзү№ејӮжҖ§з»“еҗҲгҖҒж ·жң¬иҮӘеҸ‘иҚ§е…үгҖӮ
в—Ұ и§ЈеҶіпјҡдјҳеҢ–жҠ—дҪ“зЁҖйҮҠеәҰпјҢеўһеҠ е°Ғй—ӯж—¶й—ҙпјҲ5% BSAжҲ–иЎҖжё…пјүпјҢзј©зҹӯжӣқе…үж—¶й—ҙгҖӮ
2. дҝЎеҸ·ејұжҲ–ж— дҝЎеҸ·
в—Ұ еҺҹеӣ пјҡжҠ—еҺҹиЎЁдҪҚиў«з ҙеқҸгҖҒжҠ—дҪ“еӨұж•ҲгҖҒиҚ§е…үж·¬зҒӯгҖӮ
в—Ұ и§ЈеҶіпјҡжӣҙжҚўеӣәе®ҡж–№жі•пјҲеҰӮз”ІйҶҮжӣҝд»ЈеӨҡиҒҡз”ІйҶӣпјүпјҢйӘҢиҜҒжҠ—дҪ“жҙ»жҖ§пјҢж–°йІңй…ҚеҲ¶иҚ§е…үдәҢжҠ—гҖӮ
3. йқһзү№ејӮжҖ§жҹ“иүІ
в—Ұ еҺҹеӣ пјҡдәҢжҠ—дәӨеҸүеҸҚеә”гҖҒеҶ…жәҗжҖ§IgGз»“еҗҲгҖӮ
в—Ұ и§ЈеҶіпјҡдҪҝз”Ёз§Қеұһзү№ејӮжҖ§дәҢжҠ—пјҢйў„еҗёйҷ„дәҢжҠ—жҲ–йҳ»ж–ӯеҶ…жәҗжҖ§IgGпјҲеҰӮеұұзҫҠиЎҖжё…пјүгҖӮ
4. иҚ§е…үж·¬зҒӯеҝ«
в—Ұ еҺҹеӣ пјҡе°ҒзүҮдёҚеҪ“жҲ–е…үз…§иҝҮеәҰгҖӮ
в—Ұ и§ЈеҶіпјҡдҪҝз”ЁжҠ—ж·¬зҒӯеүӮпјҢйҒҝе…үдҝқеӯҳж ·жң¬гҖӮ


