

大家好,今天给大家分享一篇(-)- 表没食子儿茶素 - 3 - 没食子酸酯(EGCG)增强玉米醇溶蛋白 -β- 乳球蛋白复合物的蛋白质相互作用:拓展分子胶在食品应用中的潜力的文章。本文的通讯作者是来自浙江工商大学食品科学与生物工程学院的谢湖均教授与黄敏副研究员。
一、创新点
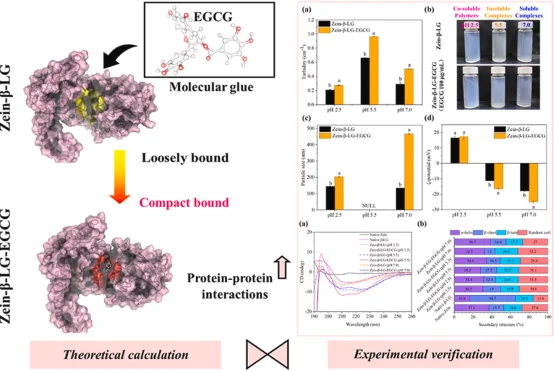
1. 首次系统研究 EGCG 作为分子胶水在 Zein-β-LG 复合物中的作用机制,涵盖从分子尺度(MD、对接)到宏观性质(粒径、电位、光谱)的多层次分析。
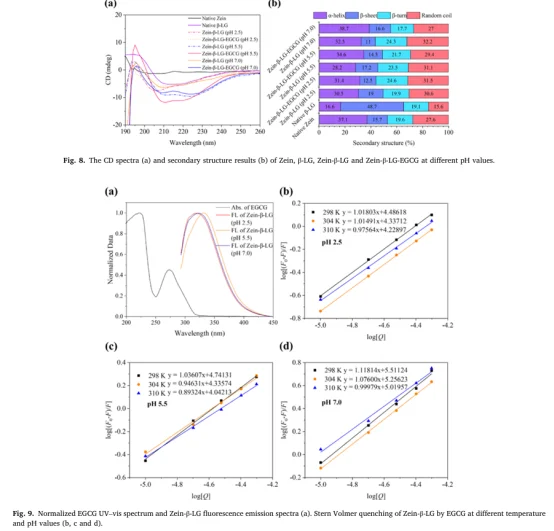
2. 结合计算化学(MD、MM/GBSA、分子对接)与多种实验技术(FTIR、CD、FL、NMR、SEM),形成理论与实验的闭环验证。
3. 揭示了 EGCG 通过“疏水屏蔽”和“氢键增强”双重机制稳定蛋白质界面,明确了其在酸性、中性和弱酸性条件下的作用差异。
二、主要实验与计算方法
1. 分子对接与结合模式分析
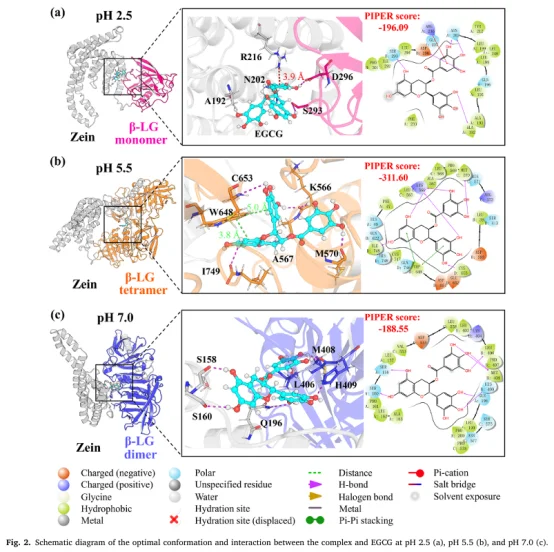
使用 Glide 对 Zein-β-LG 与 EGCG 进行半柔性对接。
分析不同 pH 下 EGCG 与蛋白质界面的相互作用类型:氢键、π-π 堆积、阳离子-π、疏水作用。
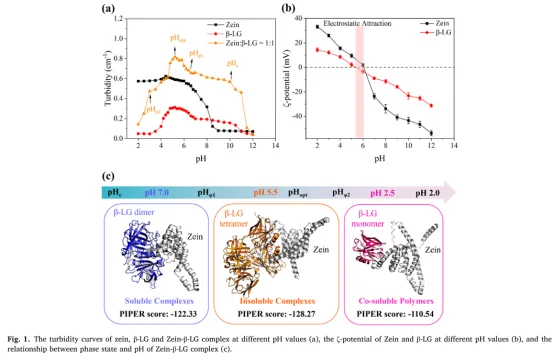
PIPER 评分 显示 EGCG 显著提升复合物结合稳定性。
2. 分子动力学模拟
使用 Amber22/ff19SB/GAFF2/TIP3P 力场与模型,进行 100 ns 模拟。
蛋白质力场 (ff19SB):这是AMBER力场系列中基于高质量量子力学数据优化的最新版本,对蛋白质骨架和二面角的描述更为精确,特别适用于模拟蛋白质构象变化和相互作用。
小分子力场 (GAFF2):通用原子力场2.0版,其参数库覆盖了大量有机分子,能较好地处理像EGCG这样具有复杂芳环和多个酚羟基的分子。
水模型 (TIP3P):与AMBER力场高度兼容,在计算效率和准确性之间取得了良好平衡,是生物体系模拟最常用的水模型之一。
电荷计算 (RESP):采用基于量子力学计算的限制性静电势电荷,能更真实地反映分子在溶液中的电子分布,对于准确计算静电相互作用至关重要。
分析指标:
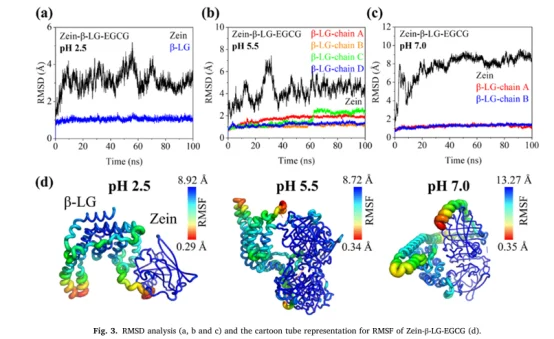
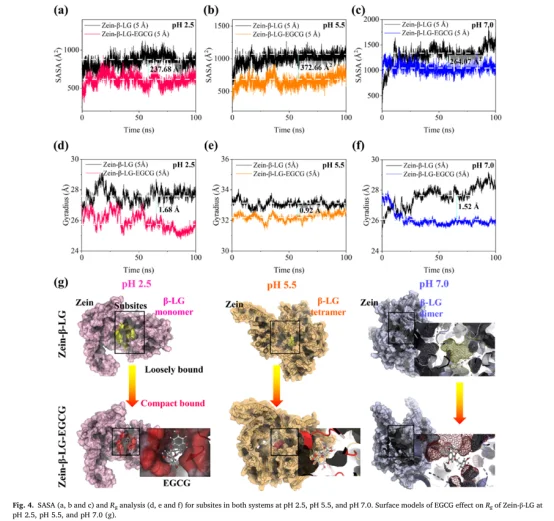
RMSD/RMSF:评估结构稳定性和柔性,证实了复合物结构的整体稳定性,并指出Zein的柔性区域是EGCG作用的主要靶点
氢键概率:量化 EGCG 与蛋白质之间的氢键形成频率,将观察到的氢键特征具体化为原子间的相互作用轨迹,明确了关键结合残基。
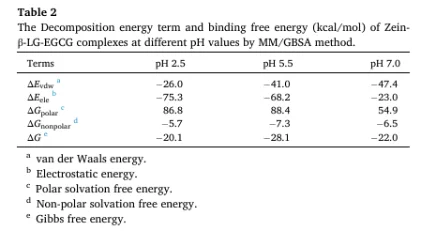
3. 结合自由能计算(MM/GBSA)
计算 ΔGbind 并分解为范德华、静电、极性与非极性溶剂化能。
结果显示在所有 pH 条件下 ΔGbind < –20 kcal/mol,表明 EGCG 与 Zein-β-LG 具有强结合亲和力。
参考文献 https://doi.org/10.1016/j.foodhyd.2025.111398
#科研 #分子动力学模拟 #分子动力学计算 #分子对接
一、创新点
1. 首次系统研究 EGCG 作为分子胶水在 Zein-β-LG 复合物中的作用机制,涵盖从分子尺度(MD、对接)到宏观性质(粒径、电位、光谱)的多层次分析。
2. 结合计算化学(MD、MM/GBSA、分子对接)与多种实验技术(FTIR、CD、FL、NMR、SEM),形成理论与实验的闭环验证。
3. 揭示了 EGCG 通过“疏水屏蔽”和“氢键增强”双重机制稳定蛋白质界面,明确了其在酸性、中性和弱酸性条件下的作用差异。
二、主要实验与计算方法
1. 分子对接与结合模式分析
使用 Glide 对 Zein-β-LG 与 EGCG 进行半柔性对接。
分析不同 pH 下 EGCG 与蛋白质界面的相互作用类型:氢键、π-π 堆积、阳离子-π、疏水作用。
PIPER 评分 显示 EGCG 显著提升复合物结合稳定性。
2. 分子动力学模拟
使用 Amber22/ff19SB/GAFF2/TIP3P 力场与模型,进行 100 ns 模拟。
蛋白质力场 (ff19SB):这是AMBER力场系列中基于高质量量子力学数据优化的最新版本,对蛋白质骨架和二面角的描述更为精确,特别适用于模拟蛋白质构象变化和相互作用。
小分子力场 (GAFF2):通用原子力场2.0版,其参数库覆盖了大量有机分子,能较好地处理像EGCG这样具有复杂芳环和多个酚羟基的分子。
水模型 (TIP3P):与AMBER力场高度兼容,在计算效率和准确性之间取得了良好平衡,是生物体系模拟最常用的水模型之一。
电荷计算 (RESP):采用基于量子力学计算的限制性静电势电荷,能更真实地反映分子在溶液中的电子分布,对于准确计算静电相互作用至关重要。
分析指标:
RMSD/RMSF:评估结构稳定性和柔性,证实了复合物结构的整体稳定性,并指出Zein的柔性区域是EGCG作用的主要靶点
氢键概率:量化 EGCG 与蛋白质之间的氢键形成频率,将观察到的氢键特征具体化为原子间的相互作用轨迹,明确了关键结合残基。
3. 结合自由能计算(MM/GBSA)
计算 ΔGbind 并分解为范德华、静电、极性与非极性溶剂化能。
结果显示在所有 pH 条件下 ΔGbind < –20 kcal/mol,表明 EGCG 与 Zein-β-LG 具有强结合亲和力。
参考文献 https://doi.org/10.1016/j.foodhyd.2025.111398
#科研 #分子动力学模拟 #分子动力学计算 #分子对接


