


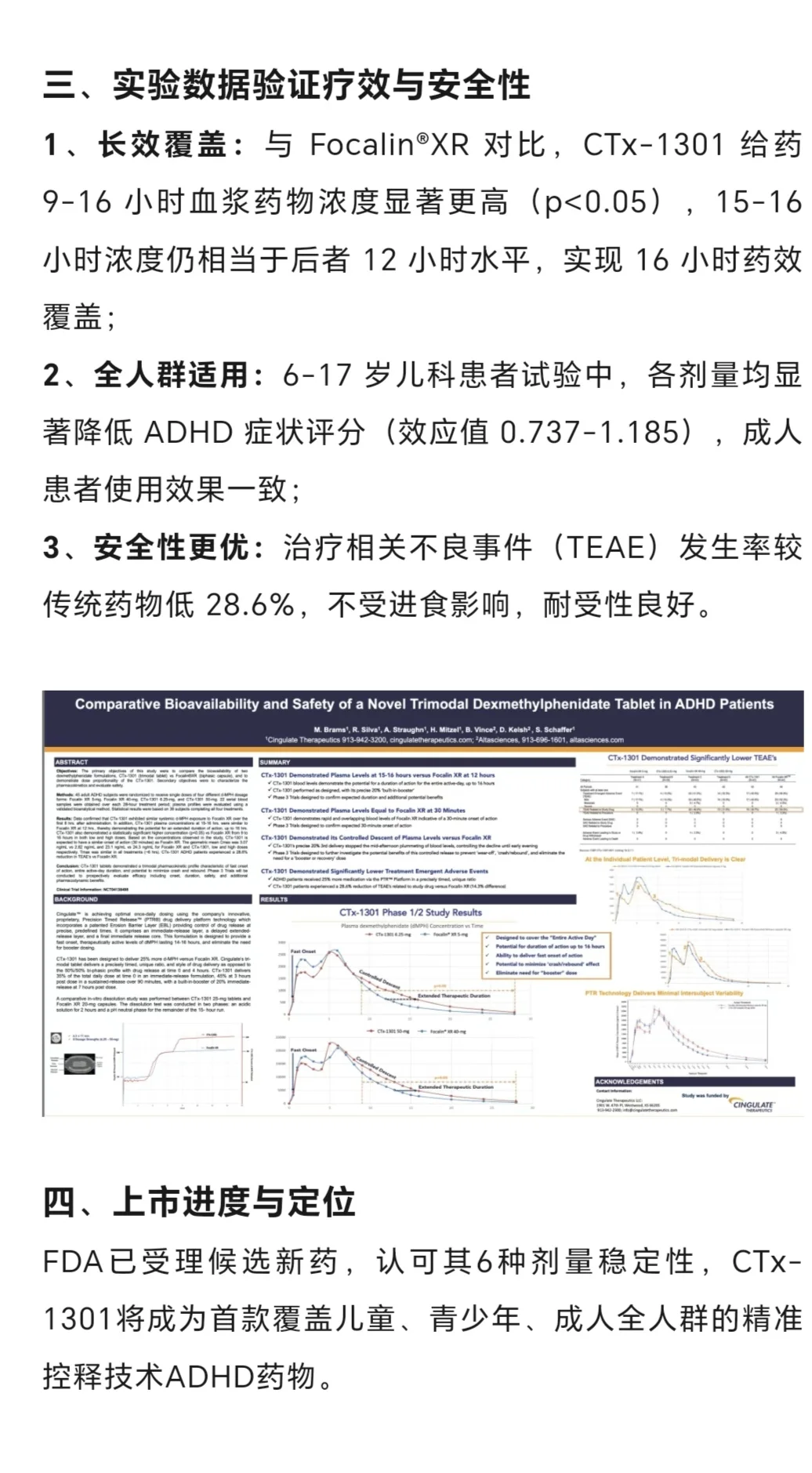
Cingulate生物制药公司于10月14日宣布,美国食品药品监督管理局(FDA)已同意受理CTx-1301用于治疗儿童和成人注意缺陷多动障碍(ADHD,俗称多动症)的新药申请(NDA)。FDA已指定处方药使用者付费法案(PDUFA)的目标行动日期为2026年5月31日。
该批准是基于一项临床试验包,其中包括一项3期成人剂量优化研究(CTx-1301-022;ClinicalTrials.gov标识符:NCT05631626)以及3期儿科固定剂量研究(CTx-1301-005试验;ClinicalTrials.gov标识符:NCT05286762)。
成人剂量优化研究在实验室教室环境中评估了CTx-1301对18至55岁ADHD患者的疗效和安全性。经过5周的剂量优化期后,研究参与者(N=21)被随机分配接受CTx-1301或安慰剂。研究结果显示,与安慰剂相比,CTx-1301治疗导致注意力有临床意义的改善,这是基于永久性产品绩效评分测量(主要终点)。
CTx-1301组的临床总体印象(CGI)-严重程度评分与基线相比也有显著的统计学变化(P <.001)。
儿科固定剂量研究评估了CTx-1301在6至17岁ADHD儿童患者中的疗效和安全性。研究参与者(N=103)被随机分配接受CTx-1301(18.75毫克、25毫克、37.5毫克)或安慰剂5周。主要终点是在第5周时ADHD评定量表5(ADHD-RS-5)评分相对于基线的平均变化。
研究结果表明,与安慰剂相比,所有剂量的CTx-1301均显著降低了基于ADHD-RS-5评分的ADHD症状(P = 0.018 [18.75毫克];P = 0.011 [25毫克];P = 0.001 [37.5毫克])。此外,CGI-改善量表和CGI-严重程度量表均报告了剂量依赖性改善。
至于安全性,所有研究中均未报告严重的治疗中出现的不良事件。耐受性特征也与其他长效哌甲酯产品相似。
参考来源:
FDA accepts Cingulate’s New Drug Application for CTx-1301 in attention-deficit/hyperactivity disorder (ADHD) and sets a May 31, 2026 PDUFA date. News release. Cingulate. October 14, 2025.
声明:以上信息转载于网络,仅供您参考。如有任何问题,请咨询医疗卫生专业人士。
#多动症 #注意缺陷多动障碍#CTx1301 #大和米蕈
该批准是基于一项临床试验包,其中包括一项3期成人剂量优化研究(CTx-1301-022;ClinicalTrials.gov标识符:NCT05631626)以及3期儿科固定剂量研究(CTx-1301-005试验;ClinicalTrials.gov标识符:NCT05286762)。
成人剂量优化研究在实验室教室环境中评估了CTx-1301对18至55岁ADHD患者的疗效和安全性。经过5周的剂量优化期后,研究参与者(N=21)被随机分配接受CTx-1301或安慰剂。研究结果显示,与安慰剂相比,CTx-1301治疗导致注意力有临床意义的改善,这是基于永久性产品绩效评分测量(主要终点)。
CTx-1301组的临床总体印象(CGI)-严重程度评分与基线相比也有显著的统计学变化(P <.001)。
儿科固定剂量研究评估了CTx-1301在6至17岁ADHD儿童患者中的疗效和安全性。研究参与者(N=103)被随机分配接受CTx-1301(18.75毫克、25毫克、37.5毫克)或安慰剂5周。主要终点是在第5周时ADHD评定量表5(ADHD-RS-5)评分相对于基线的平均变化。
研究结果表明,与安慰剂相比,所有剂量的CTx-1301均显著降低了基于ADHD-RS-5评分的ADHD症状(P = 0.018 [18.75毫克];P = 0.011 [25毫克];P = 0.001 [37.5毫克])。此外,CGI-改善量表和CGI-严重程度量表均报告了剂量依赖性改善。
至于安全性,所有研究中均未报告严重的治疗中出现的不良事件。耐受性特征也与其他长效哌甲酯产品相似。
参考来源:
FDA accepts Cingulate’s New Drug Application for CTx-1301 in attention-deficit/hyperactivity disorder (ADHD) and sets a May 31, 2026 PDUFA date. News release. Cingulate. October 14, 2025.
声明:以上信息转载于网络,仅供您参考。如有任何问题,请咨询医疗卫生专业人士。
#多动症 #注意缺陷多动障碍#CTx1301 #大和米蕈


