来源:动脉网、蛋壳研究院、动脉新医疗
编辑:Organoids
排版:青萍
近年来,随着免疫治疗、细胞治疗、基因治疗等新型治疗手段的快速发展,药企的研发强度不断提升。然而,新药研发是高成本、长周期且充满不确定性的工作。一些有潜在治疗作用的候选药物,可能由于非临床阶段的研发策略失误,导致该项目无法进入临床研究或上市阶段。一些有治疗潜力的药物,从药物设计直至上市平均需要10-15年时间,成功率仅有10%。在接近约90%的失败案例中,约30%是由于不良事件(如肝脏、心脏毒性)引起,约60%是由于缺乏疗效导致的。在非临床开发阶段需要对候选药物的药代动力学、有效性和安全性需要进行全面评估。造成如此高失败率最主要原因可能是由于在非临床阶段的二维细胞模型及动物模型的局限性,无法准确预测药物在人体内的作用。新药研发亟待新的转化工具,类器官和器官芯片由此催生,助力临床前到临床转化之间巨大鸿沟的跨越,帮助药企实现降本增效。
类器官和器官芯片是近年来生物医学工程领域的前沿技术,它们利用细胞、材料、微流控等手段,构建具有器官或组织功能的体外模型,为药物研发、疾病模拟、个性化治疗等提供了新的平台和方法。类器官和器官芯片的研究涉及多个学科,如发育生物学、干细胞生物学、生物材料学、微机电系统、生物信息学等,需要多学科交叉合作和创新。
近年来,类器官(Organoid)和器官芯片(Organ-on-Chip, OOC)技术进入新的发展阶段,从模拟简单的细胞结构到重现器官复杂的生理功能,应用场景不断丰富,包括药物筛选、作用和毒性机制研究、疾病建模、精准医疗及生物标志物与新毒性评价终点的筛选及发现等。
基础概念
类器官基础概念
类器官 (Organoid)是指利用成体干细胞或多能干细胞进行体外三维(3D)培养而形成的具有一定空间结构的组织类似物。其与对应的人类器官拥有高度相似的组织学特征,并能重现该器官的生理功能,因此也被称为“微型器官(Mini-Organ)”。
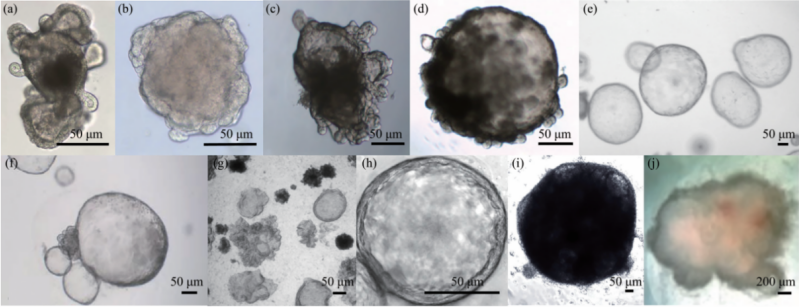
图注:(a)小肠类器官形貌图.(b)结肠类器官形貌图. (c)食管类器官形貌图.(d)胃类器官形貌图. (e)肝脏类器官形貌图.(f)胰腺类器官形貌图.(g)肺类器官形貌图.(h)乳腺类器官形貌图. (i)肾类器官形貌图.(j)脑类器官形貌图
根据细胞来源的不同,类器官主要分为成体干细胞 (Adult Stem Cell, ASC)和多能干细胞(Pluripotent Stem Cell, PSC) 来源的类器官,而PSC又分为胚胎干细胞 (Embryonicstem Cell, ESC)和诱导多能干细胞 (induced Pluripotent Stem Cell, iPSC)。
不同来源的类器官具有不同的特性及用途。例如神经外胚层如视杯、大脑类器官仅来源于PSC, 因而研究精神遗传疾病、发育生物学主要利用PSC类器官;而ASC来源于组织中具有再生能力的前体细胞,主要应用于研究成体组织生物学、组织再生和精准医疗等。
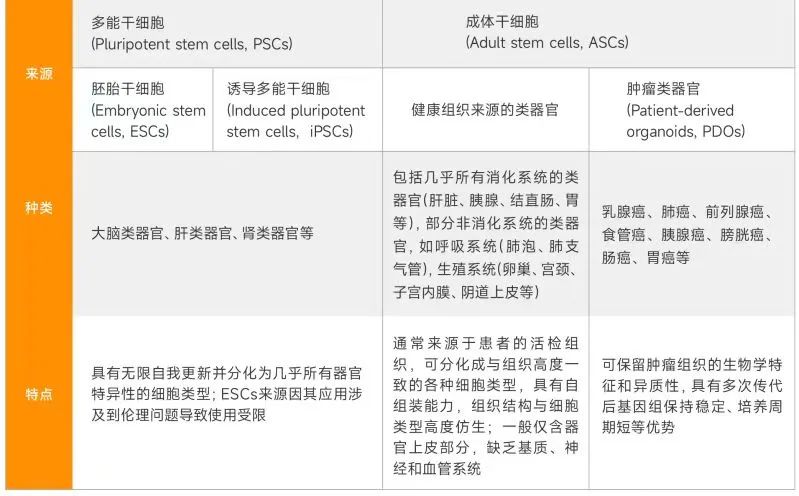
不同来源的类器官分化器官种类及其特点
来源:蛋壳研究院
多能干细胞PSC具有无限自我更新并分化为几乎所有器官特异性的细胞类型,其中胚胎干细胞ESC来源于囊胚期内细胞团的全能干细胞,因其应用涉及到伦理问题导致其使用受限。成体干细胞ASC通常来源于患者的活检组织,但其分化能力有限,而且ASC类器官一般仅含有器官的上皮部分,缺乏基质、神经和血管系统,培养体系相对比较简单。
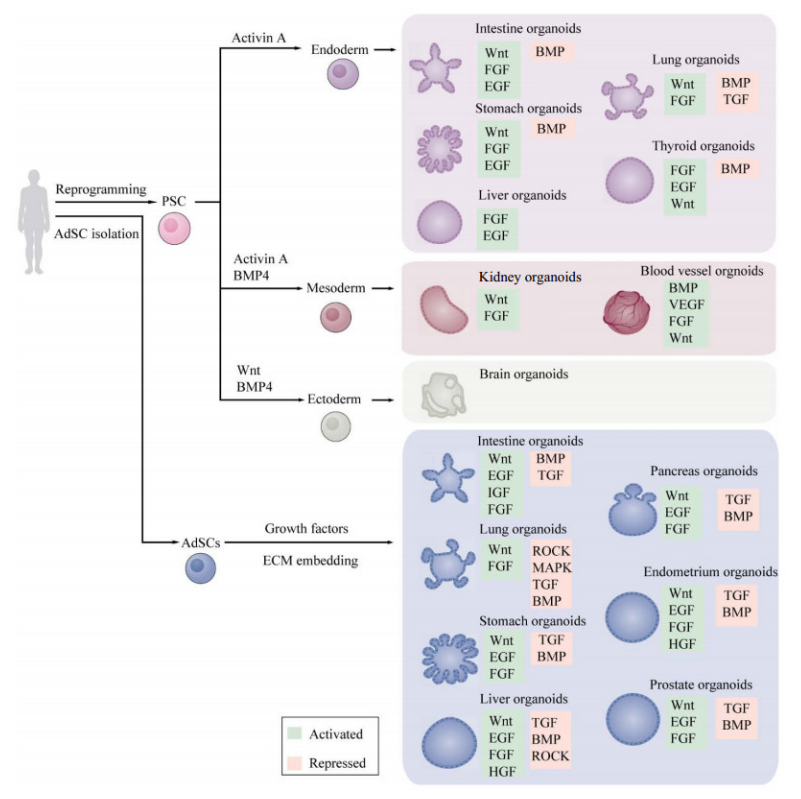
人PSC来源类器官和ASC来源类器官的形成过程 来源:《Nature Reviews Molecular Cell Biology》
器官芯片基础概念
器官芯片(Organ-On-Chip, OOC) 广义上被定义为用于体外模拟人体器官的功能单元的微型细胞培养装置。是以微流控芯片为核心,由透明塑料、玻璃或柔性聚合物(如聚二甲基硅氧烷,PDMS)等材料组成,具有多个模拟人体组织和器官环境的细胞培养分区,各分区之间通过仿生循环系统进行连接。狭义上,器官芯片特指微流控芯片及其配套使用的灌流装置。

多器官微流控框架 来源:《Nature Biotechnology》
通过与细胞生物学、生物材料和工程学等多种方法相结合,器官芯片可以在体外模拟构建包含有多种活体细胞、功能组织界面、生物流体和机械力刺激等复杂因素的组织器官微环境,反映人体组织器官的主要结构和功能特征。之所以被称为“芯片”,是因为其最初采用的微制造方法是由计算机微芯片制造方法改进而成。
类器官与器官芯片的异同
类器官和器官芯片分属不同的细分领域,具体来讲,类器官偏向生物学,属于干细胞相关领域,类器官中的干性细胞在培养过程中会向不同类型细胞分化,且分化后的细胞在空间排布、生理功能上与人体器官高度相似,但在可控性、可重复性上具有局限,其复杂程度受细胞分化能力限制。器官芯片则偏向于生物医学工程,通过微流控等技术的引入,在建模的可控性和标准化上具有优势,可通过共培养技术实现更复杂模型的构建,但往往难以兼具通量、成本和复杂度的要求。

类器官、器官芯片与类器官芯片之间的关系 来源:蛋壳研究院制图
发展历程与政策
类器官与器官芯片全球发展历程
类器官的发展历程可以追溯到20世纪初,以下是其发展历史:
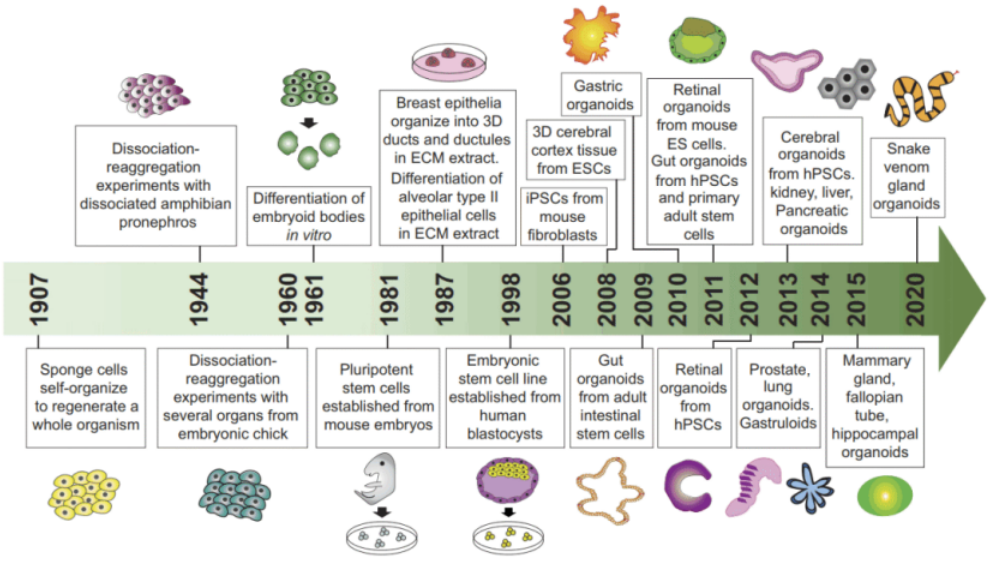
类器官全球发展历程图
来源:《American Journal of Physiology-Cell Physiology》
1907年
Henry Van Peters Wilson描述了体外再生的第一次尝试,他证明了游离的海绵细胞可以自我组织再生一个完整的生物
1944年
两栖动物前肾的分离聚合实验
1960年
鸡胚多个器官分离聚集实验
1961年
胚状体的体外分化
1981年
从小鼠胚胎中建立的多能干细胞,干细胞研究开始蓬勃发展
1987年
乳腺上皮组织成三维导管和ECM提取物中的导管
1998年
科学家们才能够从人类囊胚中分离和培养胚胎干细胞
2006年
科学家从小鼠成纤维细胞诱导制备出诱导多能干细胞(iPSC)
2008年
从胚胎干细胞生成大脑皮层组织时,类器官研究开始从2D向3D转变
2009年
从成人肠道干细胞衍生出小肠类器官
2013年
来自hPSCs的脑器官/肾/肝/胰腺类器官
2014年
前列腺,肺类器官
2015年
乳腺、输卵管、海马类器官
2020年
蛇毒腺类器官
2013年,类器官被全球顶级期刊《Science》评为“年度十大科学技术”。在2018年初,《Nature Methods》将类器官评为2017年度方法。类器官的应用主要集中于病人来源的类器官(Patient-Derived Organoids, PDOs)。因为此种方法通常用于肿瘤患者的疾病建模、研究与药物筛选,狭义上又常常被称为肿瘤类器官,比如先前学习过的使用类器官模型来研究胰腺癌。
2000年代前期,康奈尔大学的 Michael L.Shuler等人首次提出了用人体不同器官的细胞在芯片上构建人体组织,模拟人体环境的设想。2010年,哈佛大学 Donald Ingber 等人构建肺器官芯片的工作在《Science》上发表,成为器官芯片领域研究标志性的工作,引发了政府部门、科技界和产业界的高度关注。
中国类器官与器官芯片发展
中国的类器官技术起步相对较晚,但是发展迅速。2016-2021年成立的类器官企业已超过14家,陆续落地于北京、广州、上海、苏州、杭州等城市。科技部在2021年1月将“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动的重点专项任务,加速了相关产业化进程。中国科研积累的提升也在推动类器官技术的发展,中国在该领域的发表文献数量在全球排名第三位,且增长速度是全球平均水平的两倍。
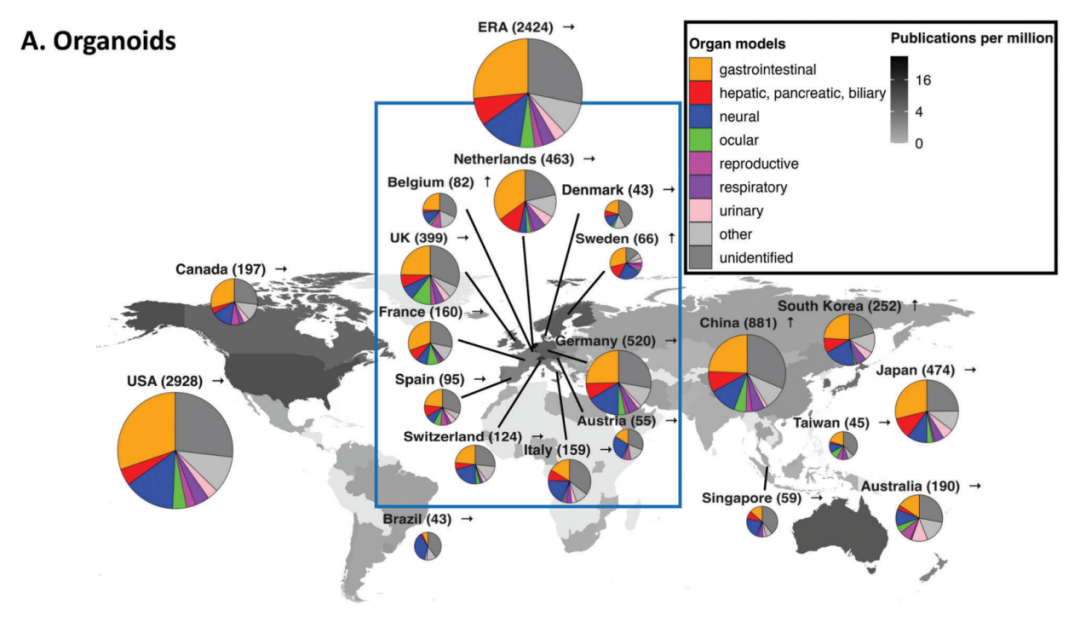
器官芯片技术方面,也取得了一定的进展。清华大学和大连化物所从事微流控研究的团队最早将微流控芯片推进到类器官/器官芯片研究。2002年,由大连理工大学王立鼎院士、东北大学方肇伦院士和清华大学罗国安教授牵头,在北京召开首届全国微全分析系统会议,开启了中国微流控芯片元年。2011年,大连理工大学微流控芯片药学研究团队成立,开始器官芯片研究。2019年,科技部首批变革性技术关键科学问题重点研发计划项目(人体器官芯片的精准介观测量)立项。同样,中国在器官芯片领域研究成果占比排名全球第三位。
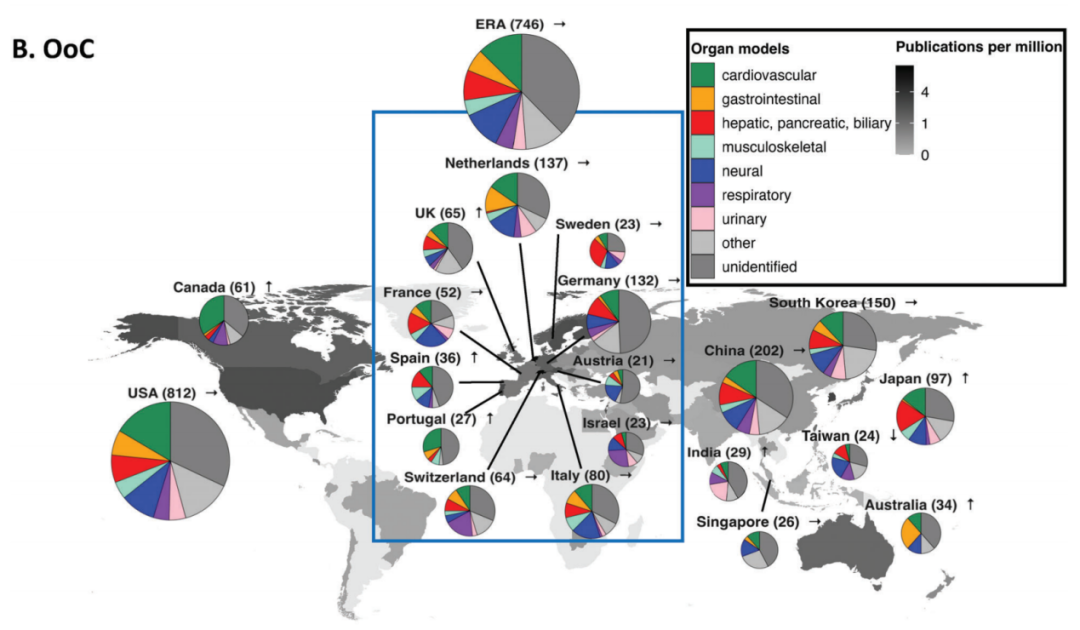
中国类器官与器官芯片政策支持
近几年,我国对类器官与器官芯片行业颁布了多项鼓励支持政策。2013年,器官芯片相关的科研就已经纳入科技部新药重大专项课题计划,2019年国家教育部和国家外专局就联合资助了由东南大学、哈佛大学、剑桥大学等联合组建的“器官芯片”高等学校学科创新引智计划基地(即“111计划”)以强化器官芯片研究的国际合作。CDE在2021年末颁布的《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》中指出:针对基因修饰细胞治疗产品“当缺少相关动物模型时,可采用基于细胞和组织的模型(如二维或三维组织模型、类器官和微流体模型等)为有效性和安全性的评估提供有用的补充信息。如果没有合适的动物模型满足试验需要,应当依据科学原理开发相应的动物模型或使用更完善的体外试验系统、替代性模型(例如类器官)开展试验。”

此外,国内近年对于实验室自建检测方法 (LDT) 试点的积极支持,也极大促进了类器官与器官芯片企业将产品应用于临床发展的热情,让企业在早期申报注册产品的过程 中能获得一部分现金流收入支持企业更好的生存发展。 目前,上海、广州等地的部分公立医疗机构已经被列为试点综合类单位。
产业链与发展现状
类器官与器官芯片行业的上游企业主要包括提供试剂、耗材和设备的制造商。这些企业为类器官与器官芯片的制造和培养提供必要的原材料,例如生物材料制造商、微流控芯片制造商、化学试剂制造商和医用材料制造商等。
中游企业则主要是进行类器官与器官芯片的研发和生产的机构。例如科研机构、初创企业和大型企业,他们利用上游企业提供的原材料和设备,研究和开发出具有特定生理功能的类器官与器官芯片。
下游企业则涉及到使用类器官与器官芯片进行各种应用的企业,高校及其他科研院所。例如在医疗领域,类器官与器官芯片可用于药物筛选、毒性测试、个体化医疗、移植医学等方面。在生命科学研究领域,它们可用于研究细胞和组织,以及疾病发病机制、药物作用机理等问题。
据蛋壳研究院不完全统计,全球类器官与器官芯片企业布局上游仪器设备或试剂耗材的企业占比高达80%。随着行业的进一步发展,中下游需求对于上游仪器设备/试剂耗材的需求总量进一步增加,部分专门打造相关仪器设备以及研发生产试剂耗材的企业也开始出现。
国内产业发展类器官的风头更盛,国外产业器官芯片企业数量占比更大。据不完全统计,目前中国以发展类器官为主要业务的企业占比国内类器官与器官芯片领域企业总量的71%,海外以发展器官芯片为主要业务的企业占比海外类器官与器官芯片领域企业总量的63% 。
目前中国对类器官的相关政策支持、产业发展积极度高,国内临床样本资源丰富,这对于类器官库的建设而言都是很大的优势。由于不同的国情,将类器官应用于临床端发展癌症精准医疗布局药敏筛查是国内区别于海外的市场需求所在。
产业应用
类器官的应用
类器官作为一个新兴的技术,在科学研究领域潜力巨大,包括发育生物学、疾病病理学、细胞生物学、再生机制、精准医疗以及药物毒性和药效试验。类器官培养使研究人体发育提供了不受伦理限制的平台,为药物筛选提供了新的平台,也是对现有2D培养方法和动物模型系统的高信息量的互补 。此外,类器官为获取更接近自然人体发育细胞用于细胞治疗成为可能。
1、通过类器官对发育和疾病进行建模
研究人员可以通过类器官来模拟人类发育和疾病,因为类器官是从人类干细胞或成年细胞产生的诱导性多能干细胞生长而来的,它们的成分和结构也与原发组织相似,并且易于操作和冷冻保存。这意味着类器官可以用于研究源自干细胞的人体组织且难以通过动物模型模拟的人类疾病分析,研究人员仅需少量的起始物质即可培养类器官。因其与对应的器官拥有类似的空间组织、保持一些关键特性并能够重现部分生理功能,而被认为是检测人类生物学和疾病方面的新模型。
2、干细胞类器官工程
干细胞生物工程技术的进步提高了控制细胞类型,组织和相互作用的能力,而类器官工程正需要通过直接修饰干细胞或控制微环境来操纵每个结构层。现在,科学家已经开发了更精确的合成环境,通过用信号蛋白修饰基质的生物惰性区域,可以更好地控制干细胞的活性。类器官工程技术对于一些体内环境成分复杂、需要精确建模的发育研究特别有用。
3、类器官与精准医疗
类器官技术正在成为个体化治疗的工具,运用类器官技术进行个体化治疗是指,通过体外对类器官进行药物筛选和基因型分析,制定适合这个个体的治疗药物和方法。截至到目前,不同肿瘤PDOs对传统和正在研发的药物所产生的反应是各种各样的。对目前有限的资源研究发现,大部分PDOs所展现的治疗反应和相对应的病人刚开始对治疗的反应是一致的。PDOs也可以用于针对被动或获得性耐受开发新的药物。更重要的是,PDOs对具有细胞毒性的药物敏感性较强,因而可以更好的预测病人使用后的临床反应。接下来,研究人员对大量个体PDOs的药物反应数据进行整合分析,找出共同特征,进而对一类相似病人进行生物标记物开发研究。
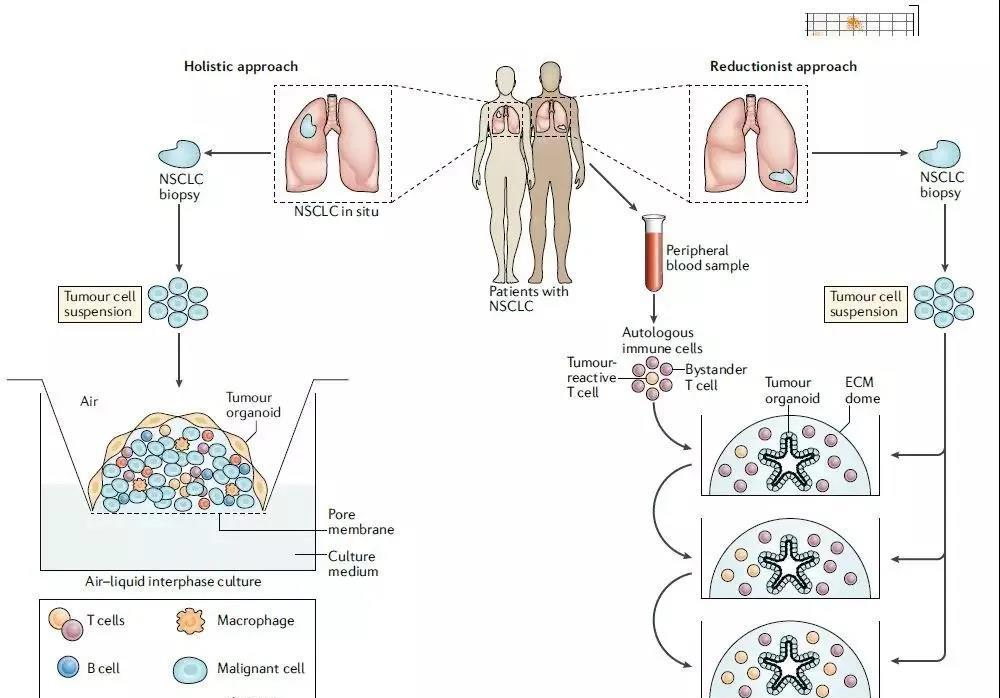
器官芯片的应用
1、脑器官芯片
一般采用双通道结构,分别形成神经血管单元的血管端和神经端,中间由多孔聚碳酸酯膜隔开,分别由两套流路系统进行控制,以模拟在体情况的血脑屏障结构。芯片一侧通道为星型胶质细胞,另一侧通道为脑微血管内皮细胞,微流泵以恒定的流速灌注培养。
2、肝器官芯片
大多是在芯片上建立肝脏的部分生理学模型,如胆小管、肝小叶、肝血窦模型等,并利用这些生理模型进行药物研发和毒理学研究。芯片肝模型的优势在于能够在微米量级形成具有部分肝功能的细胞簇,进而构成接近人体形态学的肝模型,在较长时间内保持肝脏特异性的功能。
3、肾器官芯片
利用微流控芯片系统对微流体、细胞及其微环境的操控能力,在微流控芯片上构建以在体外模拟肾脏功能为主要目标的集成微系统。肾芯片技术的出现为药物和疫苗的有效性和安全性评估,以及生物医学研究提供了更接近人体真实生理和病理条件的、成本更低的研究模型。
4、肺器官芯片
含有上下两个通道,两个通道由一种薄的柔性的多孔膜隔开。将不同的细胞培养在膜两侧:上通道为人肺泡上皮细胞,下通道为人肺微血管内皮细胞。肺芯片的微装置中诱导培养了内皮和上皮细胞,可以表现出复杂的器官层次的生理功能。
5、心脏器官芯片
能够模拟心脏的不同特性,如机械性收缩运动、分子运输、电刺激和对某些药物刺激的特定反应等。在微流体通道中培养不同类型的细胞来产生适当的心脏组织,如心肌细胞(CM)、血管内皮细胞(EC)等。此外,向心脏芯片器官模型中连续灌注培养介质可模拟心肌组织上血流引起的剪切应力,从而准确地研究心肌组织的复杂体系结构。
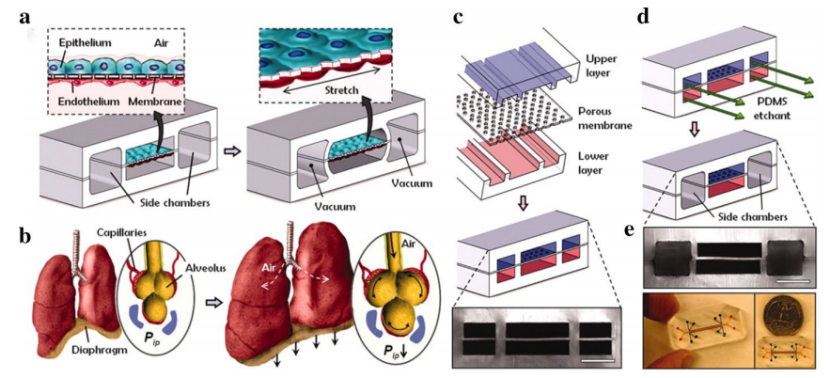
未来发展
1、行业需要进一步提升自动化、标准化程度以及提升产品通量
要想加快类器官和器官芯片的产业化进程,需要发展自动化、高通量的类器官培养设备 推动类器官培养的标准化、提升产品重现性和一致性、提升通量并降低成本,以及打造自动化的器官芯片操作设备降低下游客户使用器官芯片的复杂程度以便于推广应用。但目前行业整体自动化程度低,市场上仍缺乏成型的、实用的且在价格上表现亲民的相关仪器设备。
2、在线实时动态检测发展是行业必然,高内涵成像技术潜藏机遇与挑战
通过体外实时观测,能够观察类器官的生长过程,对类器官的培养和生产进行质控。如国外Cellesce利用在线传感器和实时监控技术,从而对类器官的生产过程进行更好的控制,确保其精确的培养条件,从而提高产量,同时控制类器官大小,减少批次间、用户间的不确定性。
对于器官芯片而言,要想评估整个系统,即多个器官之间的相互作用、细胞迁移机制以及它们之间的细胞信号传递过程,了解药物间作用过程,需要进行实时观测。在一个多种细胞共培养的体系中,要观察药物对这一体系的影响,很重要的方法是成像法。然而,光学成像设备研发门槛高,技术难度大,尤其在高内涵成像仪器方面,大部分市场基本被国外厂商垄断。
3、类器官和器官芯片培养/构建条件待优化,试剂耗材潜藏机遇
在类器官培养材料方面,诸如合成支架等新兴材料旨在弥补当前类器官培养上存在的部分局限性。在过去的20年里,大量的合成支架通过合成聚合物的方法面世,各种合成 支架的力学、物理学,化学和生物学特性可以根据细胞需求进行调节和优化,从而最大限度地模仿体内环境,保持细胞的分化,功能和增殖。
在解决器官芯片的通用培养基问题上,一些研究人员通过改变培养细胞的平台或支架 (例如硅烷)的表面化学性质,为组织提供适当的个体支持,或者利用内皮细胞屏障进行营养物质的隔离,同时循环无血清培养基,使系统达到流体流动,从而解决通用培养基问题。
4、与其他技术如Al、基因编辑等的结合
利用高内涵成像技术进行类器官和器官芯片的实时体外观测,由于三维细胞图像信息动辄数十个TB的数据,未来与Al的结合是必然。
比如通过Al进行高内涵图像数据的分析,对类器官的生长过程、药理作用进行观察,分析类器官在形态和细胞数量方面的细微变化,用于样本的质控、正常与肿瘤类器官的区分,分析类器官在用药后的变化,与现有的药筛方法进行相互验证和有效补充;根据器官体系的情况随时进行模型的精准控制以及构建策略的调整以满足FDA对于复杂体外模型构建的相关严格要求,模型本身的科学性评价;基于类器官/器官芯片模型进行高通量试验进行大数据的收集,同其他各个维度如基因组学、转录组学、蛋白质组学、代谢组学的多组学临床数据,结合Al 等新技术进行疾病机理等方面的基础研究,为新药开发提供辅助决策依据等。
关注我们
掌握类器官行业最新资讯