基因图谱构建与应用研究报告CIMA基因图谱的特色、贡献与对比分析
第一部分:基因图谱构建的基本原理
基因图谱的构建,其基本原理在于通过一系列遗传学和分子生物学技术,确定基因或特定DNA序列在染色体上的线性排列顺序与相对或绝对距离。这一过程主要依赖于两种核心方法:遗传作图和物理作图,它们共同构成了基因图谱的骨架。
1)遗传作图:基于重组率的相对定位
遗传作图的核心原理是遗传连锁与重组。在减数分裂过程中,同源染色体会发生交叉互换,导致连锁基因之间发生重组。两个基因在染色体上的距离越远,发生重组的概率(即重组率)就越高。
基本单位与计算方法:遗传距离的单位是厘摩(cM),定义为1%的重组率。通过分析杂交后代中不同性状或标记的共分离情况,可以计算出它们之间的重组率,从而确定相对距离。经典的方法是三点测交法,通过分析三个基因在杂交中的重组情况,可以确定它们的排列顺序并校正因双交换导致的误差。
标记的演进:早期遗传作图依赖形态学标记(如果蝇的眼色、翅型)和生化标记(如人类ABO血型),但多态性有限。分子生物学发展后,DNA分子标记成为主流,包括:
• 限制性片段长度多态性(RFLP):利用限制性内切酶识别位点的差异产生不同长度的DNA片段。 • 微卫星(SSR):基于短串联重复序列的拷贝数变异。 • 单核苷酸多态性(SNP):单个碱基的变异,是目前最常用、密度最高的标记。国际人类基因单体型图计划(HapMap)即是通过大规模测定SNP来构建高密度遗传图谱的代表。
2)物理作图:基于实际物理距离的绝对定位
物理作图的目标是测定基因或标记在染色体上的实际物理位置(以碱基对,bp,为单位),它是对遗传图谱的补充、精确化与最终验证。
1、关键工具与技术:
序列标签位点(STS):一段在基因组中已知序列且唯一位置的DNA短片段,是物理图谱的通用“路标”。
克隆载体技术:如酵母人工染色体(YAC),可承载大片段DNA(200-1000 kb),用于构建重叠克隆群,从而排列出DNA片段的物理顺序。
荧光原位杂交(FISH):直接将标记的DNA探针与染色体杂交,在显微镜下直观地确定基因的染色体位置。
终极目标——全序列测定:物理作图的最高形式是完成基因组DNA的全序列测定,如人类基因组计划所做的工作。这提供了最精确的**“碱基对水平”**的图谱。
3)现代整合与拓展:从线性序列到多维解析
随着技术进步,基因图谱的概念已从传统的线性定位,拓展到对基因功能与调控的动态、多维解析。
单细胞与空间转录组学:传统的群体细胞测序会掩盖细胞间的异质性。单细胞RNA测序技术通过检测单个细胞中所有基因的表达水平,能够精确定义细胞类型和状态,绘制细胞图谱。进一步结合空间转录组学,可以在保留组织原始空间结构的前提下,定位基因表达发生的位置,实现从“有哪些细胞”到“它们在哪儿、如何组织”的跨越。
多组学整合:现代图谱构建不再局限于DNA序列或基因表达。这种整合能揭示从遗传变异到基因调控,再到细胞功能和最终表型的完整链条,系统解析遗传、年龄等因素对生物系统的精细影响。
第二部分:基因图谱的实际应用与面临的挑战
基因图谱在实际应用中展现出巨大潜力,但也面临着一系列科学、技术、伦理与法律方面的严峻挑战。这些挑战贯穿于从基础研究到临床转化、再到社会应用的整个链条。
1)科学转化与技术瓶颈:从“蓝图”到“工具”的漫漫长路
数据解读的复杂性:基因图谱产生的是海量、高维度的复杂生物信息数据。如何从这些“生命天书”中准确解读出与疾病、健康相关的功能性信息,是首要难题。早期基因组学研究曾因对疾病遗传机理的复杂性预估不足而遭遇挫折,例如2010年的一项大型研究发现,收集的101种与心脏病相关的基因变体,在预测疾病方面并不比传统的家族病史研究法更有价值。这凸显了从关联性到因果机制解读的困难。
技术限制与成本压力:尽管测序技术飞速发展,成本大幅降低,但要实现大规模、高深度(如单细胞水平)的测序与应用,仍面临资源需求巨大的挑战。海量数据的存储、管理和分析需要庞大的计算资源和高性能计算平台。
2)隐私、伦理与安全:个体与社会的“双刃剑”
这是当前基因图谱应用中最受关注和争议的领域。
个人隐私与遗传歧视风险:基因信息是个人最核心的生物隐私,堪称个人的生物“说明书”。一旦泄露或被滥用,可能导致严重的遗传歧视,例如在就业、保险等领域遭受不公平对待。个人的基因信息也间接暴露了其家族成员的遗传隐私。
数据安全与恶意使用风险:高精度的群体基因图谱属于敏感的国家生物信息资源。其数据安全关乎公众健康、国家安全和社会公共利益。存在数据被窃取、跨境不当流动,甚至在极端情况下被用于设计具有人群针对性的生物工具的风险。因此,我国已通过《生物安全法》、《人类遗传资源管理条例》等法律法规,严格管控人类遗传资源的采集、保藏、利用和对外提供。
伦理与法律规范滞后:基因技术的快速发展常常使伦理和法律规范面临滞后。例如,如何确保基因数据在科研共享与隐私保护之间取得平衡?如何界定临床影像、数据是否属于人类遗传资源并进行管理?如何确保贡献基因数据的个体或群体能够公平地分享科研成果带来的惠益?这些都是亟待明确和解决的伦理与法律问题。
3)临床应用与健康公平:从“可能”到“普惠”的障碍
临床验证与有效转化难:将基因图谱上的发现转化为稳定、可靠的临床诊断工具或有效疗法,过程漫长且充满不确定性。许多疾病的遗传机制极为复杂,涉及多基因、环境互作。早期一些基于基因工程概念的药物,因与传统药物相比优势不明显而未能成功。这表明,在基础科学原理尚未完全阐明时,医学应用往往操之过急。
健康公平性与可及性问题:基于基因图谱的精准医疗技术(如靶向药物、个性化治疗方案)往往价格昂贵。如果缺乏有效的普惠机制,可能加剧医疗资源分配的不平等,形成“基因鸿沟”,即只有少数人能享受最先进的基因医疗服务,而大多数人无法获益。确保技术发展的普惠性,是重要的社会挑战。
第三部分:华大CIMA基因图谱的特色、贡献与对比分析
1)基因图谱的国际背景:主要欧美类似项目
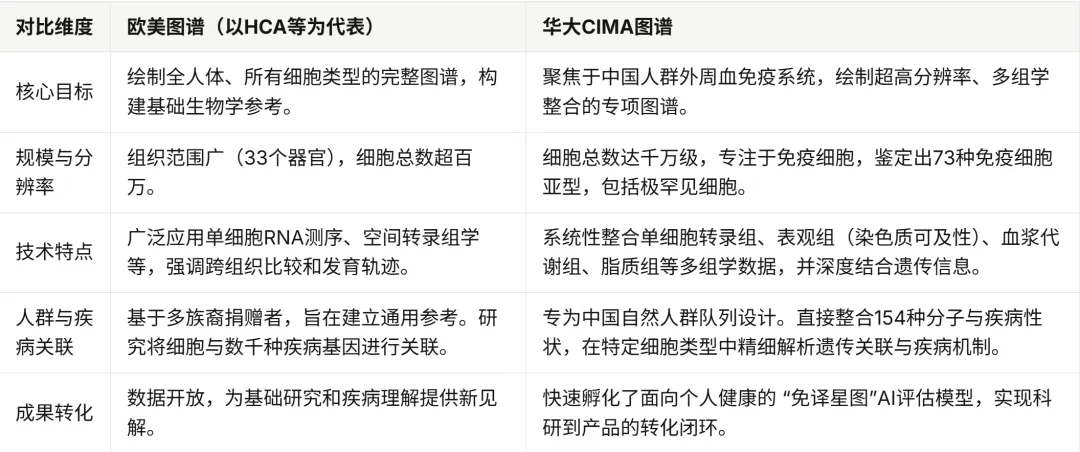
欧美有类似的基因图谱项目,并且已经公布了多项重要成果。这些项目与华大(CIMA)的研究目标相似,但在研究范围、技术路径和人群侧重点上各有特色。
人类细胞图谱计划:这是全球范围内最宏大、最知名的单细胞图谱计划,由国际联盟推动。其目标是为人体中的每一种细胞类型绘制图谱。2025年,该联盟发布了里程碑式成果,创建了涵盖人体33个器官和系统中超过一百万个细胞的高度详细图谱。
Tabula Sapiens 数据集:作为人类细胞图谱的一部分,由陈·扎克伯格生物中心领导的研究创建了 Tabula Sapiens 数据集。该研究使用活细胞的单细胞RNA测序,分析了来自同一供体的多个器官,提供了近50万个细胞的独特广泛的跨组织图谱。
跨组织免疫细胞图谱:同样隶属于人类细胞图谱计划,欧美团队也发布了针对免疫系统的专项图谱。例如,有研究对来自12个成年器官捐赠者的16个组织中的33万个免疫细胞进行了RNA测序,识别出约一百种不同类型的免疫细胞及其组织分布。另一项研究则创建了跨越9个器官的人类免疫系统发育图谱。
2)华大CIMA基因图谱的突破性特色
免疫细胞图谱,特别是像华大生命科学研究院发布的千万级高分辨率人群免疫多组学图谱(CIMA),正在为个性化医疗带来革命性的变革。其特色与贡献如下:
1、实现疾病风险的精准预测与机制解析
CIMA图谱通过整合多组学数据,能够将遗传变异精准定位到特定的免疫细胞类型,并阐明其如何通过调控特定基因和通路来影响疾病。例如,研究清晰地揭示了一个哮喘风险变异是在特定的调节性T细胞中,通过调控基因表达、改变炎症因子水平来起作用的。
2、指导“因人而异”的精准治疗与用药
CIMA研究揭示,超过三分之二的疾病相关变异具有细胞类型特异性。这解释了为什么治疗反应存在个体差异。未来,结合患者的免疫细胞图谱,医生可以实现 “量身定制”的治疗方案。
3、建立中国人群专属的健康基准与评估工具
CIMA填补了高质量免疫参考数据多基于欧洲人群的空白,为东亚人群提供了系统性的高分辨率基础资源。基于此孵化的**“免译星图”AI评估模型**,能够以高达0.94的相关性精准评估个体的“免疫年龄”。
4、加速新药靶点发现与药物研发
理解疾病在特定细胞类型中的精确机制,是发现新药靶点的关键。CIMA不仅提供了海量的潜在靶点线索,其创新的CIMA细胞语言模型还能高效预测非编码变异的功能,辅助评估靶点的成药潜力。
3)与欧美主导项目的对比分析
第四部分:综合总结与展望
综合来看,基因图谱的构建是一个从宏观连锁现象推导相对位置,到利用分子标记与克隆技术进行物理定位,最终通过高通量测序获得精确序列,并借助单细胞与多组学技术向动态、空间和功能维度不断深化的过程。它为理解生命奥秘、解析疾病机制和推动精准医学奠定了最核心的数据基础。
同时,其实际应用也是一场需要科学界、产业界、政府和社会公众共同参与的复杂系统工程。它要求我们不仅要在技术上不断突破解读与分析的瓶颈,更要在治理上建立健全的伦理规范、法律框架和安全监管体系(如加强数据匿名化、加密等技术防护),并在社会层面推动公平可及,最终才能让这项揭示生命奥秘的技术真正安全、负责任地造福于全人类。
在国际层面,欧美在单细胞图谱领域起步较早,人类细胞图谱(HCA) 作为一项全球性科学工程,在广度(多组织)和基础资源建设上取得了领先成果。而华大发布的CIMA图谱则是在特定方向(免疫系统)和特定人群(中国人群)上实现了深度与精度的超越。它不仅填补了中国人群高精度免疫参考数据的空白,更通过多组学整合和AI模型开发,实现了从基础图谱到疾病机制解析、再到健康产品应用的快速闭环,为中国人群的个性化医疗提供了更直接、更精准的数据基石。
展望未来,基因图谱研究将继续向更高分辨率、更动态的时空维度、以及更深度的因果关系解析发展。对于中国而言,在积极参与国际合作的同时,必须牢牢掌握对本国人群遗传资源数据的主导权,并同步构建完善的生物安全、数据隐私保护和伦理治理体系。只有这样,才能确保基因图谱这一强大工具,在保障国家安全的前提下,最大限度地服务于人民的健康福祉,推动精准医学从科学愿景走向普遍现实。