1. 试剂配制:
· JC-1储备液:用高纯度DMSO将JC-1粉末溶解为1-5 mM的储备液,分装后-20℃避光保存,避免反复冻融。
· JC-1工作液:使用无血清细胞培养液或PBS(含Ca²⁺/Mg²⁺)稀释储备液,终浓度通常为2-10 µM。现用现配,并确保DMSO最终浓度低于0.1%。
· 阳性对照液:配制50-100 µM的羰基氰间氯苯腙(CCCP)溶液,用于完全瓦解线粒体膜电位作为阴性对照。
2. 细胞准备:
· 将细胞接种于共聚焦培养皿或玻片中,待其密度达到60%-80%汇合度时进行实验。
二、 染色步骤
1. 细胞洗涤:弃去旧培养液,用预温的PBS(37℃)轻柔润洗细胞1-2次,去除残留血清(血清会干扰染色)。
2. 染料加载:
· 向每个样品中加入适量配制好的JC-1工作液,确保完全覆盖细胞。
· 将细胞放入37℃、5% CO₂的培养箱中,避光孵育15-30分钟。具体时间需根据细胞类型和染料浓度进行优化。
3. 染料清洗:
· 小心吸弃JC-1工作液。
· 用预温的PBS或细胞培养液轻柔润洗细胞2-3次,彻底去除未进入细胞的染料,降低背景荧光。
4. (可选)复染与固定:
· 活细胞成像:建议在染色后立即进行活细胞成像,以获得最真实的结果。可在清洗后加入新鲜预温的无血清培养液。
· 固定细胞:若需固定,使用含4%多聚甲醛的PBS在室温避光固定15分钟,之后用PBS清洗。注意固定可能影响荧光信号。
三、 图像采集与分析
1. 立即在荧光显微镜或共聚焦显微镜下观察。
2. 双通道检测:
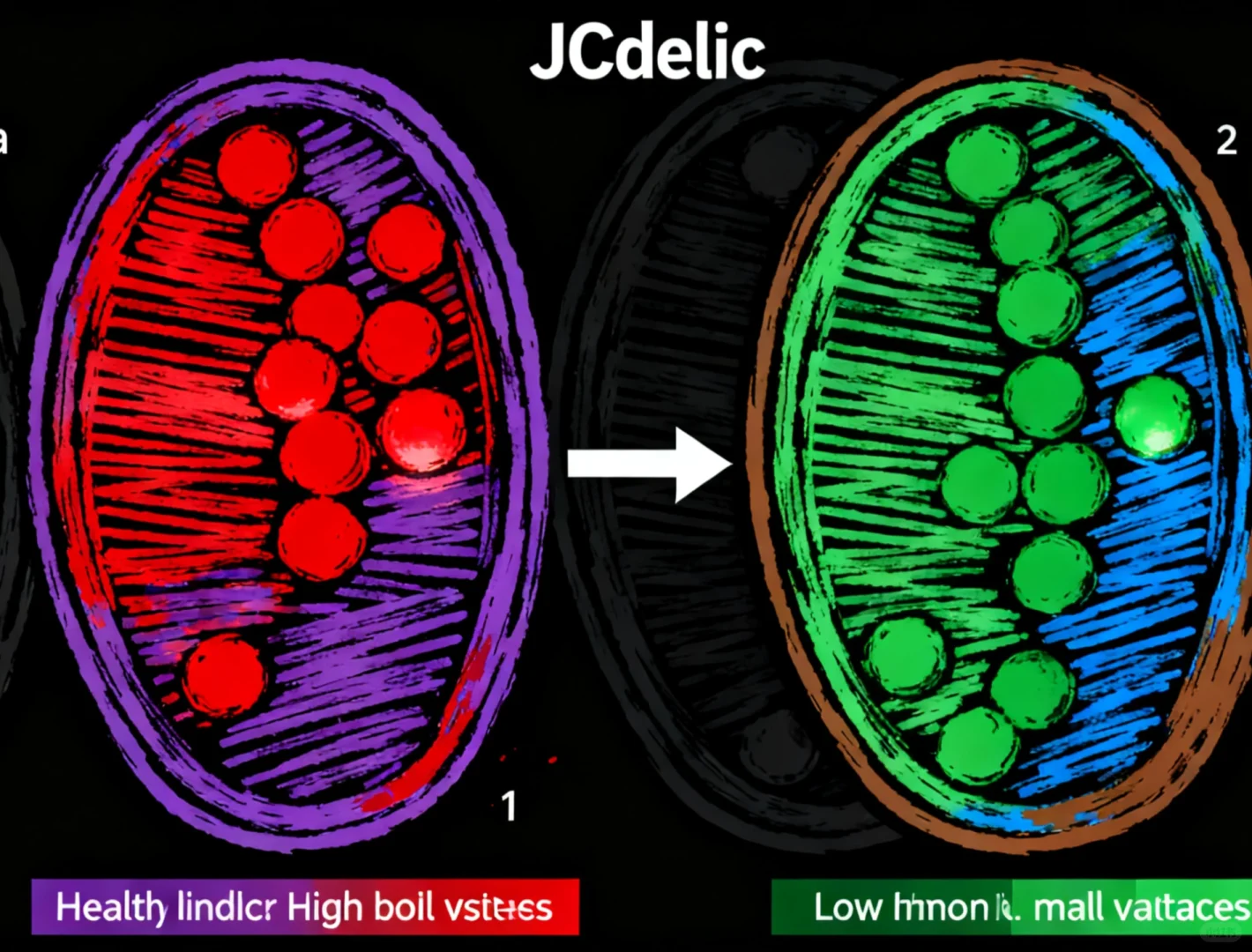
· JC-1聚合物(J-aggregates):激发光/发射光通常为 585 nm / 590 nm(红色荧光),代表高膜电位。
· JC-1单体(Monomer):激发光/发射光通常为 514 nm / 529 nm(绿色荧光),代表低膜电位。
3. 结果分析:
· 正常细胞:线粒体呈现明亮的红色荧光(高膜电位) 和较弱的绿色荧光。
· 膜电位下降的细胞:红色荧光减弱或消失,绿色荧光增强(低膜电位)。
· 通过计算红/绿荧光强度的比值,可以半定量地评估膜电位的变化,比值下降表明膜电位降低。
关键注意事项:
· 全程避光操作。
#细胞实验 #线粒体膜电位检测
· JC-1储备液:用高纯度DMSO将JC-1粉末溶解为1-5 mM的储备液,分装后-20℃避光保存,避免反复冻融。
· JC-1工作液:使用无血清细胞培养液或PBS(含Ca²⁺/Mg²⁺)稀释储备液,终浓度通常为2-10 µM。现用现配,并确保DMSO最终浓度低于0.1%。
· 阳性对照液:配制50-100 µM的羰基氰间氯苯腙(CCCP)溶液,用于完全瓦解线粒体膜电位作为阴性对照。
2. 细胞准备:
· 将细胞接种于共聚焦培养皿或玻片中,待其密度达到60%-80%汇合度时进行实验。
二、 染色步骤
1. 细胞洗涤:弃去旧培养液,用预温的PBS(37℃)轻柔润洗细胞1-2次,去除残留血清(血清会干扰染色)。
2. 染料加载:
· 向每个样品中加入适量配制好的JC-1工作液,确保完全覆盖细胞。
· 将细胞放入37℃、5% CO₂的培养箱中,避光孵育15-30分钟。具体时间需根据细胞类型和染料浓度进行优化。
3. 染料清洗:
· 小心吸弃JC-1工作液。
· 用预温的PBS或细胞培养液轻柔润洗细胞2-3次,彻底去除未进入细胞的染料,降低背景荧光。
4. (可选)复染与固定:
· 活细胞成像:建议在染色后立即进行活细胞成像,以获得最真实的结果。可在清洗后加入新鲜预温的无血清培养液。
· 固定细胞:若需固定,使用含4%多聚甲醛的PBS在室温避光固定15分钟,之后用PBS清洗。注意固定可能影响荧光信号。
三、 图像采集与分析
1. 立即在荧光显微镜或共聚焦显微镜下观察。
2. 双通道检测:
· JC-1聚合物(J-aggregates):激发光/发射光通常为 585 nm / 590 nm(红色荧光),代表高膜电位。
· JC-1单体(Monomer):激发光/发射光通常为 514 nm / 529 nm(绿色荧光),代表低膜电位。
3. 结果分析:
· 正常细胞:线粒体呈现明亮的红色荧光(高膜电位) 和较弱的绿色荧光。
· 膜电位下降的细胞:红色荧光减弱或消失,绿色荧光增强(低膜电位)。
· 通过计算红/绿荧光强度的比值,可以半定量地评估膜电位的变化,比值下降表明膜电位降低。
关键注意事项:
· 全程避光操作。
#细胞实验 #线粒体膜电位检测