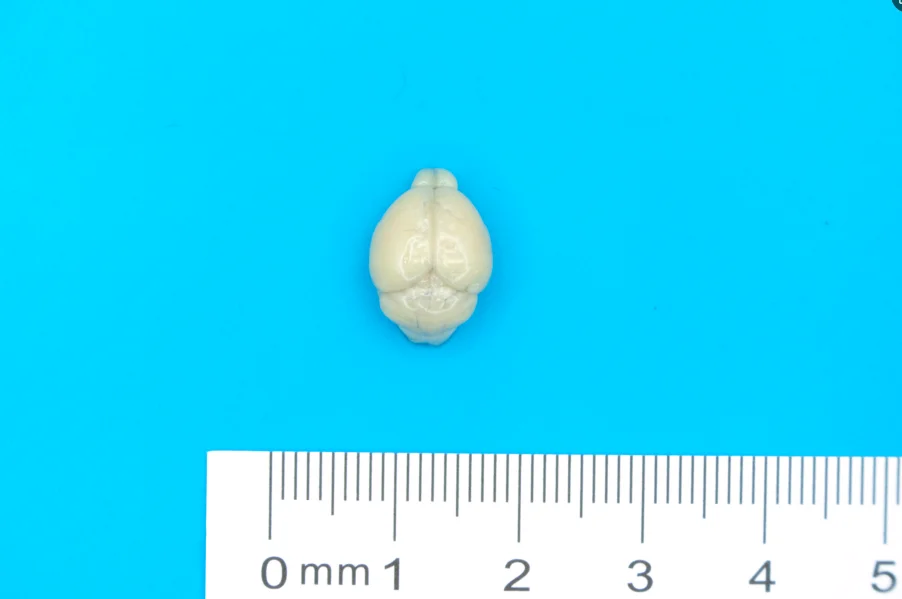
小鼠脑组织取材是神经科学研究中的基础操作,常用于组织学分析(如HE染色、免疫组化)、分子生物学检测(如PCR、Western blot)或电镜观察等。以下是标准化的取材流程及注意事项:
一、实验前准备
1. 器材与试剂:
· 解剖器械:眼科剪、镊子(直头和弯头)、骨钳、手术刀片
· 灌注装置(注射器、导管)、生理盐水、4%多聚甲醛(PFA)
· 冰块、冻存管(用于速冻组织)、OCT包埋剂(用于冰冻切片)
· 麻醉剂(如异氟烷或戊巴比妥钠)
2. 动物准备:
· 成年小鼠(根据实验需求选择品系和年龄),实验前禁食4-6小时(减少胃肠内容物干扰)。
二、标准化取材流程
步骤1:麻醉与安乐死
· 麻醉:
使用异氟烷吸入麻醉(诱导浓度3-5%,维持1-2%),或腹腔注射戊巴比妥钠(50 mg/kg)。
确认麻醉深度:夹趾无反应、呼吸平稳。
· 安乐死:
· 若需灌注固定(组织学实验):直接进入灌注步骤。
· 若无需灌注(如新鲜组织提取RNA):颈椎脱臼法快速处死。
步骤2:经心灌注(适用于组织固定)
1. 开胸暴露心脏:
· 固定小鼠于解剖板,酒精消毒胸腹部皮肤。
· 剪开胸腔,暴露心脏,剪破右心耳(放血口)。
2. 灌注操作:
· 灌注生理盐水:将灌注针(25G)插入左心室,缓慢灌注预冷生理盐水(约20 mL),至肝脏和肺脏变白、右心耳流出液清澈。
· 灌注4% PFA:换用4%多聚甲醛继续灌注(20-30 mL),至小鼠四肢和尾巴僵硬。
· 目的:清除血液、固定组织,减少红细胞残留对后续实验的干扰。
步骤3:取脑操作
1. 快速断头:
· 用锋利剪刀在枕骨大孔处断头,将头部置于冰上预冷。
2. 剥离皮肤与颅骨:
· 用镊子剥离头部皮肤,暴露颅骨。
· 用骨钳从枕骨大孔处小心剪开颅骨,沿矢状缝向两侧剥离(避免损伤脑组织)。
3. 完整取出脑组织:
· 用弯头镊子轻轻托起嗅球,将脑组织从颅底缓慢分离,注意保留视神经和脑干连接。
· 将全脑置于预冷的生理盐水或PFA中(根据实验需求)。
一、实验前准备
1. 器材与试剂:
· 解剖器械:眼科剪、镊子(直头和弯头)、骨钳、手术刀片
· 灌注装置(注射器、导管)、生理盐水、4%多聚甲醛(PFA)
· 冰块、冻存管(用于速冻组织)、OCT包埋剂(用于冰冻切片)
· 麻醉剂(如异氟烷或戊巴比妥钠)
2. 动物准备:
· 成年小鼠(根据实验需求选择品系和年龄),实验前禁食4-6小时(减少胃肠内容物干扰)。
二、标准化取材流程
步骤1:麻醉与安乐死
· 麻醉:
使用异氟烷吸入麻醉(诱导浓度3-5%,维持1-2%),或腹腔注射戊巴比妥钠(50 mg/kg)。
确认麻醉深度:夹趾无反应、呼吸平稳。
· 安乐死:
· 若需灌注固定(组织学实验):直接进入灌注步骤。
· 若无需灌注(如新鲜组织提取RNA):颈椎脱臼法快速处死。
步骤2:经心灌注(适用于组织固定)
1. 开胸暴露心脏:
· 固定小鼠于解剖板,酒精消毒胸腹部皮肤。
· 剪开胸腔,暴露心脏,剪破右心耳(放血口)。
2. 灌注操作:
· 灌注生理盐水:将灌注针(25G)插入左心室,缓慢灌注预冷生理盐水(约20 mL),至肝脏和肺脏变白、右心耳流出液清澈。
· 灌注4% PFA:换用4%多聚甲醛继续灌注(20-30 mL),至小鼠四肢和尾巴僵硬。
· 目的:清除血液、固定组织,减少红细胞残留对后续实验的干扰。
步骤3:取脑操作
1. 快速断头:
· 用锋利剪刀在枕骨大孔处断头,将头部置于冰上预冷。
2. 剥离皮肤与颅骨:
· 用镊子剥离头部皮肤,暴露颅骨。
· 用骨钳从枕骨大孔处小心剪开颅骨,沿矢状缝向两侧剥离(避免损伤脑组织)。
3. 完整取出脑组织:
· 用弯头镊子轻轻托起嗅球,将脑组织从颅底缓慢分离,注意保留视神经和脑干连接。
· 将全脑置于预冷的生理盐水或PFA中(根据实验需求)。