
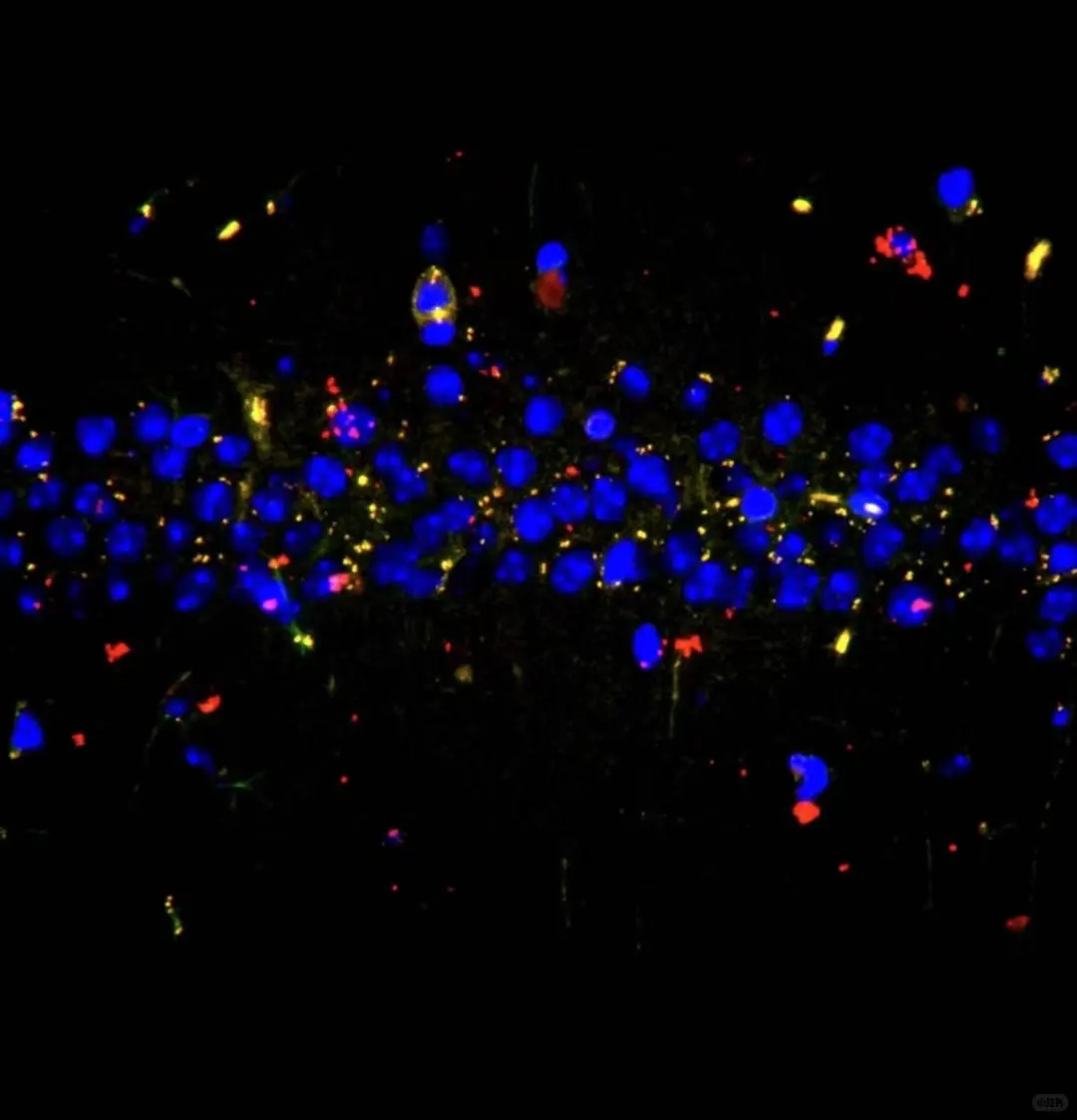
一、细胞准备
1. 找状态好的细胞,倒掉旧培养基,加消化液让细胞脱落,轻轻吹打成单细胞悬液。
2. 把圆形爬片放进24孔板里(每个孔放一片)
3. 根据细胞生长快慢,取适量细胞悬液加到有爬片的孔里,放进37℃培养箱让细胞贴壁生长
二、固定细胞
1. 倒掉培养基,用PBS洗细胞3次(每次轻轻晃一晃,洗掉残留培养基)
2. 每孔加1mL的4%多聚甲醛,室温固定10-20分钟(让细胞“定格”,防止蛋白跑掉)倒掉多聚甲醛。
3. 再用PBS洗2次,每次5分钟(洗去多聚甲醛残留)
三、通透处理
1. 每孔加1mL的0.5% Triton-X100(让细胞膜“变通透”,方便抗体进去),室温放10分钟,倒掉
2. 用PBS洗2次,每次5分钟(洗掉Triton-X100,避免影响后续抗体结合)
四、封闭杂信号
每孔加1mL的3% BSA封闭液(用牛血清蛋白堵住细胞表面非特异性结合位点),室温放1小时,倒掉
五、一抗孵育(关键!)
1. 把一抗按说明书稀释好,滴在爬片上(别滴太多,能盖住细胞就行)用锡箔纸包住孔板避光,放4℃冰箱过夜(让抗体和目标蛋白“一对一结合”)
2. 第二天用PBS洗5次,每次5分钟(洗去未结合的一抗,减少背景杂色)
六、二抗孵育(显色关键)
1. 用封闭液稀释二抗(二抗能“抓住”一抗,自带荧光标签)室温避光孵育1小时(别让荧光二抗见光,会失效)
2. 用PBS洗5次,每次5分钟(彻底洗掉未结合的二抗,避免荧光干扰)
七、DAPI染细胞核
1. 按1:4000稀释DAPI(蓝色荧光染核,按试剂盒说明来)每孔加1mL,避光染10分钟(别太久,核会太亮)
2. 用PBS洗3次,每次5分钟(洗掉多余DAPI,防止非特异性染色)
八、封片和拍照
1. 用镊子小心夹出爬片,用吸水纸吸掉多余液体(别碰到细胞!)在载玻片上滴5μL抗荧光淬灭剂(防止荧光“褪色”)
2. 把爬片细胞面朝下盖在液滴上,轻轻压平,等边缘干一点,用透明指甲油涂一圈固定(防止液体漏出)
3. 暂时不拍就放4℃冰箱避光存着,尽快用激光共聚焦显微镜拍照(记得选对荧光通道哦!)
? 小提醒:
• 全程轻柔操作,别冲掉细胞!
• 二抗和DAPI一定要避光,否则荧光会“跑掉”!
• 爬片取放用镊子,别用手碰,防止污染!
收藏这篇,跟着步骤做,新手也能轻松搞定免疫荧光~
1. 找状态好的细胞,倒掉旧培养基,加消化液让细胞脱落,轻轻吹打成单细胞悬液。
2. 把圆形爬片放进24孔板里(每个孔放一片)
3. 根据细胞生长快慢,取适量细胞悬液加到有爬片的孔里,放进37℃培养箱让细胞贴壁生长
二、固定细胞
1. 倒掉培养基,用PBS洗细胞3次(每次轻轻晃一晃,洗掉残留培养基)
2. 每孔加1mL的4%多聚甲醛,室温固定10-20分钟(让细胞“定格”,防止蛋白跑掉)倒掉多聚甲醛。
3. 再用PBS洗2次,每次5分钟(洗去多聚甲醛残留)
三、通透处理
1. 每孔加1mL的0.5% Triton-X100(让细胞膜“变通透”,方便抗体进去),室温放10分钟,倒掉
2. 用PBS洗2次,每次5分钟(洗掉Triton-X100,避免影响后续抗体结合)
四、封闭杂信号
每孔加1mL的3% BSA封闭液(用牛血清蛋白堵住细胞表面非特异性结合位点),室温放1小时,倒掉
五、一抗孵育(关键!)
1. 把一抗按说明书稀释好,滴在爬片上(别滴太多,能盖住细胞就行)用锡箔纸包住孔板避光,放4℃冰箱过夜(让抗体和目标蛋白“一对一结合”)
2. 第二天用PBS洗5次,每次5分钟(洗去未结合的一抗,减少背景杂色)
六、二抗孵育(显色关键)
1. 用封闭液稀释二抗(二抗能“抓住”一抗,自带荧光标签)室温避光孵育1小时(别让荧光二抗见光,会失效)
2. 用PBS洗5次,每次5分钟(彻底洗掉未结合的二抗,避免荧光干扰)
七、DAPI染细胞核
1. 按1:4000稀释DAPI(蓝色荧光染核,按试剂盒说明来)每孔加1mL,避光染10分钟(别太久,核会太亮)
2. 用PBS洗3次,每次5分钟(洗掉多余DAPI,防止非特异性染色)
八、封片和拍照
1. 用镊子小心夹出爬片,用吸水纸吸掉多余液体(别碰到细胞!)在载玻片上滴5μL抗荧光淬灭剂(防止荧光“褪色”)
2. 把爬片细胞面朝下盖在液滴上,轻轻压平,等边缘干一点,用透明指甲油涂一圈固定(防止液体漏出)
3. 暂时不拍就放4℃冰箱避光存着,尽快用激光共聚焦显微镜拍照(记得选对荧光通道哦!)
? 小提醒:
• 全程轻柔操作,别冲掉细胞!
• 二抗和DAPI一定要避光,否则荧光会“跑掉”!
• 爬片取放用镊子,别用手碰,防止污染!
收藏这篇,跟着步骤做,新手也能轻松搞定免疫荧光~